
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)仪器B和D的作用是___,按图示加入试剂,E中的试剂是___(选填下列字母编号)。
A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D.饱和食盐水
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为___。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经___(填写操作名称)、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是___,然后再向C中烧瓶加入硫化钠和碳酸钠的混合溶液。
(6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到氯水颜色变浅(或褪色),说明有还原性(已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为___。
【答案】安全瓶(或防倒吸) C 2S2-+CO![]() +4SO2=3S2O
+4SO2=3S2O![]() +CO2 蒸发结晶 向沉淀中加入足量稀盐酸 先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽 S2O
+CO2 蒸发结晶 向沉淀中加入足量稀盐酸 先向A中烧瓶滴加浓硫酸,产生的气体将装置中的空气排尽 S2O![]() +4Cl2+5H2O=2SO
+4Cl2+5H2O=2SO![]() +10H++8Cl-
+10H++8Cl-
【解析】
根据装置可知,A装置制备SO2,C装置制备Na2S2O3,B、D装置是防倒吸的,由于SO2有毒,需要尾气处理,因此E装置是吸收SO2的。由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液。
II.(1)SO2易溶于水,实验中要防止倒吸,B和D的作用是安全瓶(或防倒吸);由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液,答案为C。
(2)向A中烧瓶滴加浓H2SO4,Na2SO3与浓H2SO4反应生成Na2SO4、SO2气体和H2O,SO2与C中Na2S和Na2CO3混合溶液反应生成Na2S2O3和CO2,则离子方程式为:2S2-+CO32-+4SO2=3S2O32-+CO2。
(3)由于Na2S2O3·5H2O是无色透明晶体,易溶于水,因此要从溶液中得到硫代硫酸钠晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.(4)向产品溶解液中滴加足量BaCl2溶液,有白色沉淀生成,过滤、洗涤沉淀,选择向沉淀物中加入的试剂,稀硝酸有氧化性,可以把亚硫酸根氧化为硫酸根离子,从而无二氧化硫生成,不能证明有Na2SO3,而稀硫酸会引进硫酸根离子,不能证明原溶液中含有硫酸根离子,蒸馏水不与沉淀反应;所以再向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(5)由于亚硫酸盐易被氧化生成硫酸盐,而装置中含有空气,空气中的氧气可以氧化Na2S2O3使之生成Na2SO4,所以在不改变原有装置的基础上为减少装置C中生成的Na2SO4的量,改进后的措施是先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液。
(6)该反应中Na2S2O3被氧化为Na2SO4,Cl2还原为Cl-,反应的离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-,所以若看到氯水颜色变浅(或褪色),说明有还原性。


科目:高中化学 来源: 题型:
【题目】钴(Co)与钛(Ti)是均可与强酸发生反应的金属。利用电解原理电解CoCl2溶液制取钴,工作原理如图所示,其中Ti-Ru为惰性电极。下列说法正确的是
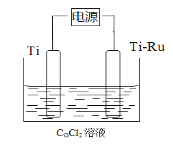
A. 电解时控制CoCl2溶液的pH在0~1范围内
B. 电解过程中Cl在Ti电极放电生成氯气
C. Ti-Ru的作用是作为损耗阳极材料和传递电流
D. 用CoSO4代替CoCl2会使钴的产率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷水溶液法是科学家近期研制出的一种使沙漠变绿洲的新技术。它是先在沙漠中喷洒一定量的聚丙烯酸酯(![]() )“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下30—50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用。下列对聚丙烯酸酯的说法中,不正确的是( )
)“水溶液”,“水溶液”中的高分子化合物与沙土粒子结合,在地表下30—50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截蓄积雨水的作用。下列对聚丙烯酸酯的说法中,不正确的是( )
A.在一定条件下能发生加成反应
B.它可由CH2=CH—COOR经过加成聚合反应而得到
C.在一定条件下能发生水解反应
D.合成它的小分子化合物是CH2=CH—COOR
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:
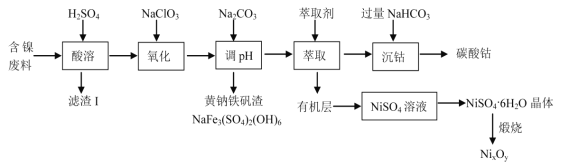
已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
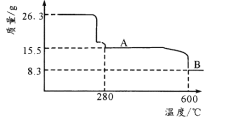
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molOD-中含有的质子数和中子数均为9NA
B.60g正戊烷与12g新戊烷的混合物中共价键数为17NA
C.11.2L氯气与足量镁粉充分反应,转移的电子数为NA
D.1L0.1mo1·L-1CH3COONa溶液中,CH3COO-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
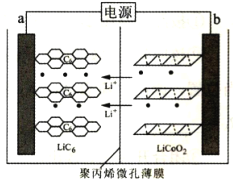
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铜转炉烟灰(主要成分ZnO还有Pb、Cu、Cd、As、Cl、F等元素)中回收锌、铜、铅等元素进行资源综合利用,具有重要意义。以铜转炉烟灰制备重要化工原料活性氧化锌的工艺流程如图所示。
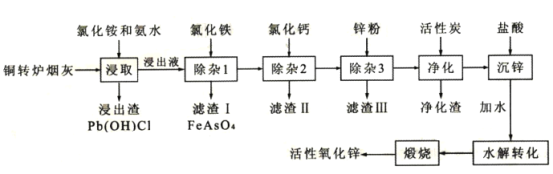
己知:活性炭净化主要是除去有机杂质。
请回答以下问题:
(1)若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
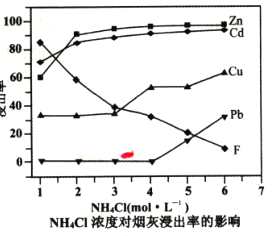
(2)在反应温度为50℃,反应时间为lh时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,结合流程图分析,氯化铵适宜的浓度为___ mo1·L-1。
(3)若浸出液中c(AsO43-)=6.0×10-3molL-1,现将8.0×10-3mo1L-1FeC13溶液与浸出液等体积混合生成砷酸铁沉淀。若该温度时Ksp(FeAsO4)=2.0×10-22,则反应后溶液中c(AsO43-)=___mo1L-1。
(4)滤渣II的主要成分为___;除杂3是置换除杂过程,则此过程主要除去的金属有___(填化学式)。
(5)沉锌得到的物质为Zn(NH3)2C12,请写出水解转化的化学方程式___。
(6)该流程中可以循环使用的物质的电子式为___。
(7)取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是
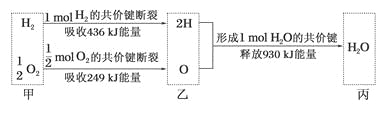
A.H2O分解为H2与O2时放出热量
B.1molH2与0.5molO2完全反应生成1mol H2O时放出热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成了一种能自动愈合自身内部细微裂纹的神奇塑料,合成路线如图所示:
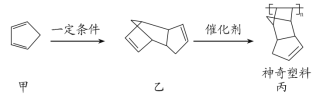
下列说法正确的是( )
A.甲的化学名称为2,4-环戊二烯
B.一定条件下,1mol乙与1molH2加成的产物可能为![]()
C.若神奇塑料的平均相对分子质量为10000,则其平均聚合度约为90
D.甲的所有链状不饱和烃稳定结构的同分异构体有四种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com