
【题目】己知NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molOD-中含有的质子数和中子数均为9NA
B.60g正戊烷与12g新戊烷的混合物中共价键数为17NA
C.11.2L氯气与足量镁粉充分反应,转移的电子数为NA
D.1L0.1mo1·L-1CH3COONa溶液中,CH3COO-数目为0.1NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的碱性比X比Z弱
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.常温下,1 L 0.5 mol/L CH3COONH4 溶液的 pH=7,则溶液中 CH3COO-与 NH4+的数目均为 0.5NA
B.10 g 质量分数为 46%的乙醇溶液中含有氢原子的数目为 0.6 NA
C.16g 氨基(-NH2)中含有的电子数为 7 NA
D.在密闭容器中将 2 mol SO2 和 1 mol O2 混合反应后,体系中的原子数为 8 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力。
(1)查阅资料可知:2KMnO4+16HCl(浓)═ 2MnCl2 + 2KCl + 5Cl2↑ + 2H2O。某同学设计图1所示装置来制备纯净、干燥的氯气,其中实验装置或试剂有错误的是______
A ①② B ② C ②③ D ①③


(2)将图1装置修改正确后,虚框④是收集Cl2的装置,请从图2中选用合适的装置__。
(3)将制得的Cl2进行性质实验,装置如图3所示(加热装置省略),请回答以下问题。

①装置E中可观察到____;反应的化学方程式____。
②装置F在反应中的作用是_____。
③装置G所得的溶液中具有漂白性的分子是___,
④装置H的作用____。
(4)工业漂白粉常用Cl2与石灰乳反应制得,反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
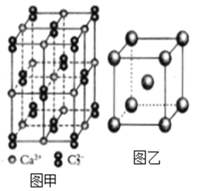
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)仪器B和D的作用是___,按图示加入试剂,E中的试剂是___(选填下列字母编号)。
A.浓H2SO4 B.饱和NaHSO3溶液 C.NaOH溶液 D.饱和食盐水
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4,C中反应生成Na2S2O3和CO2,写出C中反应的离子方程式为___。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经___(填写操作名称)、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,___,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是___,然后再向C中烧瓶加入硫化钠和碳酸钠的混合溶液。
(6)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到氯水颜色变浅(或褪色),说明有还原性(已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列四种重要的有机物。
CH2=CH2 

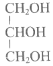
① ② ③ ④
(1)常用作液体燃料的是________(填序号,下同)。
(2)常用作配制化妆品保湿成分的是________。
(3)能用于制备酚醛树脂的是________。
(4)其产量常作为衡量石油化工发展水平的标志的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年6月《自然》刊波尔原子结构模型100周年。波尔在人类对原子结构的认识的历程上是非常重要的。以下关于人类对原子结构的认识错误的是( )

A. 汤姆逊发现电子
B. 道尔顿提出近代原子学说
C. 卢瑟福通过α粒子散射实验总结出原子结构葡萄干布丁模型
D. 玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列物质中:
(1)互为同分异构体的是______
(2)互为同素异形体的是_______
(3)互为同位素的是__________
(4)属于同一种物质的是______
(5)互为同系物的是__________ (填序号)
①液氯和氯气 ②白磷和红磷 ③(CH3)3CCH2CH3和(CH3)2CHCH(CH3)2 ④![]() 和
和![]() ⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
⑤(CH3)2CHCH3和CH3(CH2)2CH3 ⑥O2和O3 ⑦CH4和CH3CH2CH3
Ⅱ.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH ⑦Na2O2 ⑧NH4Cl ⑨C2H6 ⑩H2O2
请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是_______。
(2)只含离子键的离子化合物是______。
(3)含极性共价键的离子化合物是_________。
(4)含非极性共价键的离子化合物是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com