
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )
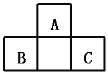
A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
科目:高中化学 来源: 题型:
【题目】(1)化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化:
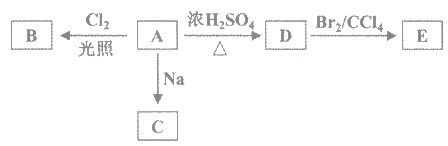
(1)①A只有一种一氯取代物B。写出由A转化为B的化学方程式_________。
②A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是____。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”的一硝基取代物只有一种,“HQ"的结构简式________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧化钠溶液作用得到化学式为(C10H12O2Na2)的化合物。“TBHQ"的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
Ⅰ.(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①基态Ni2+的核外电子排布式为_________________。
②在[Ni(NH3)6]2+中存在的化学键有(_____________)
A.离子键 B.共价键 C.配位键 D. 氢键 E.σ键 F.π键
Ⅱ.丁二酮肟是检验Ni2+的灵敏试剂。
(2)丁二酮肟分子![]() 中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
中C原子轨道杂类型为________________,1mol丁二酮肟分子所含σ键的数目为_____________。
(3)配合物[Ni(CO)4]常温下为液态,易溶于CCl4、苯等有机溶剂。
① [Ni(CO)4]固态时属于________晶体(填晶体类型)。
②[Ni(CO)4]中Ni与CO的C原子形成配位键。不考虑空间构型,[Ni(CO)4]的结构可用示意图表示为_____________ (用“→”表示出配位键) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为![]()
C.r与m可形成离子化合物,其阳离子电子式为![]()
D.一定条件下,m能与Z的单质反应生成p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备次硫酸氢钠甲醛(NaHSO2·HCHO·2H2O)的步骤如下:向烧瓶中的亚硫酸钠溶液通入SO2制得NaHSO3。将装置A中导气管换成橡皮塞,再加入锌粉和甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤,将滤液置于真空蒸发仪蒸发浓缩,冷却结晶。下列说法错误的是( )
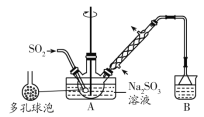
A.可用亚硫酸钠固体和70%硫酸来制取二氧化硫气体
B.多孔球泡的作用是增大气体与溶液的接触面积,使反应充分进行
C.装置B中试剂可以是NaOH或Na2CO3溶液
D.装置A中可采用油浴或沙浴加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的氧化剂、漂白剂和消毒剂。它在NCP疫情控制中发挥重要作用。
(1)工业生产双氧水常采用催化剂—乙基蒽醌法,其反应过程如图所示:

写出工业制备H2O2(1)反应的热化学方程式___。
(2)过氧化氢还可以通过电解-水解法制得。工业上用Pt作电极材料,电解硫酸氢铵饱和溶液得到过二硫酸铵[(NH4)2S2O8],然后加入适量硫酸以水解过二硫酸铵即得到过氧化氢。写出阳极的电极反应式___;整个过程的总化学方程式是___。
(3)某课题组在298K时研究H2O2+2HI=2H2O+I2反应速率的影响因素,实验结果如下表:
试验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
分析上述数据,写出反应速率与物质浓度的关系式___;该反应的速率常数(k)的值为___。
(4)过氧化氢是强氧化剂,在许多反应中有重要的应用。在一定温度下,将0.4molN2H4(g)和0.6molH2O2(g)装入2L固定容积的容器中,发生反应N2H4(g)+2H2O2(g)![]() N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
N2(g)+4H2O(g) ΔH<0,当N2H4(g)的转化率为50%时反应达到平衡,该反应的化学平衡常数的值为___。
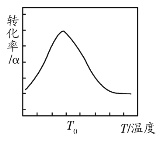
实验测得反应中N2H4(g)的转化率(α)与温度(T)的关系如图所示,分析说明温度高于T0时,N2H4(g)的转化率下降的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的结构,用化学用语完成下列问题。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||||||||||||
(1)表中有编号的元素中化学性质最不活泼的,其原子结构示意图为__;④与⑤按照原子个数比1∶1形成的化合物中含有的化学键有___。
(2)①与②形成的最简单化合物的空间构型为__,将此化合物与⑧的单质混合于一干燥的集气瓶,密封后放在光亮处一段时间后,观察到的现象是__。
(3)由③形成的单质的电子式为__;⑤与⑦的最低价形成的化合物的电子式为__。
(4)⑧的最高价氧化物对应的水化物的化学式是___;①分别与④、⑦形成的简单化合物的稳定性由强到弱的顺序是__。
(5)④、⑥、⑧三种元素的原子形成的简单离子中半径由大到小的顺序是__。
(6)运用你掌握的化学理论,设计一个实验,证明⑦的非金属性比②强__(用化学方程式表示出反应原理)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式中正确的有()
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2=2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2=2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-=Fe(OH)3↓
A.2项B.3项C.4项D.5项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com