
����Ŀ��ʵ�����Ʊ����������Ƽ�ȩ(NaHSO2��HCHO��2H2O)�IJ������£�����ƿ�е�����������Һͨ��SO2�Ƶ�NaHSO3����װ��A�е����ܻ�����Ƥ�����ټ���п�ۺͼ�ȩ��Һ����80��90���£���ӦԼ3h����ȴ�����£����ˣ�����Һ�����������������Ũ������ȴ�ᾧ������˵��������ǣ� ��
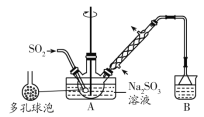
A.�����������ƹ����70%��������ȡ������������
B.������ݵ�������������������Һ�ĽӴ������ʹ��Ӧ��ֽ���
C.װ��B���Լ�������NaOH��Na2CO3��Һ
D.װ��A�пɲ�����ԡ��ɳԡ����
���𰸡�D
��������
A����Ũ�������������Ӧ���ʣ��Һ�ˮ���٣����Լ��ٶ���������ܽ⣬���Կ����ÿ����������ƹ����70%��������ȡ�����������壬��A��ȷ��
B��������ݿ�������������Һ��ĽӴ�������ӿ�������������ʣ�ʹ��Ӧ��ֽ��У���B��ȷ��
C��װ��B��������Ҫ������δ��Ӧ�Ķ�������NaOH��Na2CO3��Һ������SO2��Ӧ�������գ���C��ȷ��
D����Ӧ�¶�Ϊ80��90��������ˮԡ���ȼ��ɣ���ԡ��ɳԡ�¶ȹ��ߣ���D����
�ʴ�ΪD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
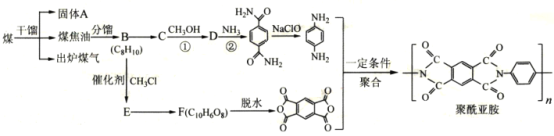
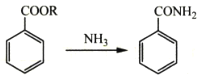
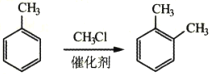
����Ŀ�������ǰ����ۺ�������ѵ��л��߷��Ӳ���֮һ���ѹ㷺Ӧ���ں��ա����졢���ӵ�����ij�����ǰ��ĺϳ�·����ͼ�����ַ�Ӧ��������ȥ����
��֪������Ϣ��
�ٷ����廯����B��һ�ȴ���������
��
��
�ش��������⣺
��1������A��___��д���ƣ���B�Ļ�ѧ������___��
��2����Ӧ�ٵĻ�ѧ����ʽΪ___��
��3��D�й����ŵ�����Ϊ___����Ӧ�ڵķ�Ӧ������___��
��4��E�ķ���ʽΪ___����֪1mo1F��������NaHCO3��Ӧ����4mo1CO2����F�Ľṹ��ʽ��___��
��5��X��C��Ϊͬ���칹�壬д��ͬʱ��������������X�Ľṹ��ʽ___��
�ٺ˴Ź���������ʾ���ֲ�ͬ��ѧ�������⣬������֮��Ϊ2��2��1��1
������NaOH��Һ��Ӧ��1mo1X�������4mo1NaOH
���ܷ���ˮ�ⷴӦ����ˮ�����֮һ����FeC13��Һ������ɫ��Ӧ
��6�����������ϳ�·�ߣ��Լױ��ͼ״�Ϊԭ�ϣ����Լ���ѡ����ƺϳ�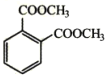 ��·��___��
��·��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ��Cu2O����һ����;�㷺�Ĺ����ϣ�ij��������ͭ��ʯ����CuFeS2��Cu2S�ȣ�Ϊԭ����ȡCu2O�Ĺ����������£�
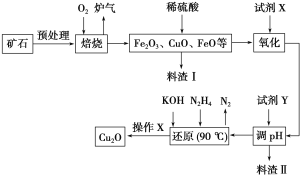
�����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±���
Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 7.5 | 2.7 | 4.8 |
��ȫ���� | 9.0 | 3.7 | 6.4 |
(1)¯���е��к�����ɷ���__________��Cu2S��O2��Ӧʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(2)���Լ�X��H2O2��Һ��д����Ӧ��Ӧ�����ӷ���ʽ��________�����Լ�X��______ʱ���������ڽ��������ɱ���
(3)�����Լ�Y��pHʱ��pH�ĵ��ط�Χ��___________��
(4)д����N2H4�Ʊ�Cu2O�Ļ�ѧ����ʽ��________������X����_________��ϴ�ӡ���ɣ����к��ʱҪ������������Ŀ����____________��
(5)��ͭ��ʯī���缫�����Ũ��ǿ������Һ���Ƶ�����Cu2O��д������������Cu2O�ĵ缫��Ӧʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йع輰�����β��ϵ�˵����ȷ����![]()
A.SiO2�ȿ�����NaOH��Һ��Ӧ��Ҳ����������ᷴӦ�����SiO2��������������
B.�ߴ��ȵĹ赥�ʹ㷺�����������ά
C.��ͨ������ʯӢ������ˮ��Ⱦ����ڹ����β���
D.��ʯ����Ҫ�ɷ�ΪKAlSi3O8������������ʽ��ʾΪK2OAl2O36SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��Ϊ������Ԫ�أ����������ڱ��е�λ����ͼ����֪B��C��Ԫ�������ڱ���������֮����AԪ��������2����B��CԪ�ص�ԭ������֮����AԪ��ԭ��������4������A��B��C���ڵ�һ���ǣ� ��
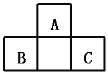
A.Be��Na��AlB.B��Mg��SiC.O��P��ClD.C��Al��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����������ı�0.1mol��L-1��Ԫ����H2C2O4��Һ��pH����Һ�е�H2C2O4��HC2O4-��C2O42-�����ʵ���������(X)��pOH�ı仯��ͼ��ʾ����֪pOH=-lgc(OH-)��![]() ����������������ǣ� ��
����������������ǣ� ��
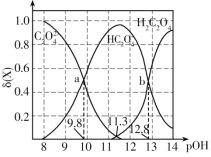
A.��ӦH2C2O4+C2O42-![]() 2HC2O4-��ƽ�ⳣ����ֵΪ103
2HC2O4-��ƽ�ⳣ����ֵΪ103
B.�������¶ȣ�a���ƶ���������
C.pH=3ʱ��![]() =100.6��1
=100.6��1
D.���ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1��Na2C2O4��NaHC2O4�����Һ�У�c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʰ�������[(H2NCH2COO)2Fe]��һ�����Ͳ�������ij��ѧѧϰС������ͼ��ʾװ��(�г�����ʡ��)�Ʊ��ʰ���������
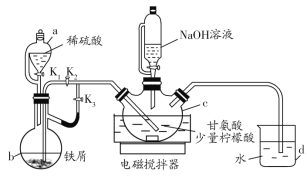
�й������������±���ʾ��
�ʰ���(H2NCH2COOH) | ������ˮ�������Ҵ��������ᣬ�ڱ��������ܽ�ȴ������Ҵ��е��ܽ�ȡ� |
������ | ������ˮ���Ҵ������Խ�ǿ����ǿ��ԭ�ԡ� |
�ʰ������� | ������ˮ���������Ҵ��������ᡣ |
ʵ�鲽�����£�
��.��K1��K3����c��ͨ�����壬��ȷ��c�п������ž���b����Һ���뵽c�С�
��.��50������������ô������������Ͻ��裬Ȼ����c�еμ�NaOH��Һ������ҺpH��5.5���ң�ʹ��Ӧ���ַ�Ӧ��
��.��Ӧ��ɺ���c�з�Ӧ���Һ�м�����ˮ�Ҵ������ɰ�ɫ���������������ˡ�ϴ�ӵôֲ�Ʒ�����ֲ�Ʒ������þ�Ʒ��
�ش��������⣺
��1������b��������__��d��������__��
��2��������н�b����Һ���뵽c�еIJ�����__�����������������ҺpHƫ�ߣ������ôֲ�Ʒ�л��������___(д��ѧʽ)��
��3��c�����ɸʰ��������Ļ�ѧ����ʽ��__��
��4�����й��ڸ�ʵ���˵���������__(��д���)��
a.������п���d�е���ð�����ݵĿ������ж�װ���еĿ����Ƿ��ž�
b.��Ӧ���Һ�м���������������Ƿ�ֹFe2+������
c.������м�����ˮ�Ҵ��������ǽ��ʰ����������ܽ��
d.������г���ϴ��ʱ��������ˮ��ϴ�Ӽ�
��5����ҵ�ϳ��ø������ڷ�ˮ��ϵ�еζ��ʰ���ķ����ⶨ��Ʒ�еĸʰ���ĺ����������ʵ�飬�����ôֲ�Ʒ�еĸʰ���������ֱ�����ڵζ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɫ�����й�����ζ��Һ�塣ijͬѧ����12.0mL96%�ܶ�Ϊ1.05g/mL�����ᡢ23mL95%�ܶ�Ϊ0.75g/mL���Ҵ���12.0mLŨ���ᡢ����Na2CO3��Һ�Ʊ�������������ʵ��װ����ͼ��ʾ���ձ������ּг�װ�á��¶ȼ�����ȥ����
��֪�����Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 117.9 | 77.2 |

������������ƿB�м����Լ�__��Ȼ��ͨ������A��������__��
�ڼ��ȱ�����ԡ�¶�Ϊ135��145�棬��������Һ��������ֹͣ���ȣ�
��ȡ����֧�ܵ���ƿ����һ�����ı���Na2CO3��Һ��������������εؼ������Һ�У��ٽ�������Һ����ȥˮ�㣬�õ��л��㡣
�Իش��������⣺
��1����������ƿB�����Լ�__��Ȼ��ͨ������A��������__��
��2��д���Ʊ����������Ļ�ѧ����ʽ__��
��3������A��������__��Ũ�����������__������C��������__��
��4����Ӧ�����õ��Ҵ��ǹ����ģ���Ŀ����__��
��5�����м��뱥��̼������Һ������__����������������εؼ��뱥��̼���Ƶ�ԭ����__��
��6���Ӣ��з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ��뱥���Ȼ�����Һ�����__���ټ�����ˮ�����ƣ�Ȼ����������ռ�77.2�����֣��Եõ���������������9.2g�������ʵ�����������������IJ���Ϊ__��д������ı���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z ����ѧ��ѧ�г������������ʣ��±���������֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����ϵ����
X | Y | Z | ��ͷ���������ֵķ�Ӧ���� | ||
A�� | NO | NO2 | HNO3 | �ٳ��������� |
|
B�� | Cl2 | NaClO | HClO | ��ͨ��CO2 | |
C�� | Na2O2 | NaOH | NaCl | �ۼ���H2O2 | |
D�� | Al2O3 | NaAlO2 | Al(OH)3 | �ܼ�NaOH��Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com