
����Ŀ��������������ɫ�����й�����ζ��Һ�塣ijͬѧ����12.0mL96%�ܶ�Ϊ1.05g/mL�����ᡢ23mL95%�ܶ�Ϊ0.75g/mL���Ҵ���12.0mLŨ���ᡢ����Na2CO3��Һ�Ʊ�������������ʵ��װ����ͼ��ʾ���ձ������ּг�װ�á��¶ȼ�����ȥ����
��֪�����Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 117.9 | 77.2 |

������������ƿB�м����Լ�__��Ȼ��ͨ������A��������__��
�ڼ��ȱ�����ԡ�¶�Ϊ135��145�棬��������Һ��������ֹͣ���ȣ�
��ȡ����֧�ܵ���ƿ����һ�����ı���Na2CO3��Һ��������������εؼ������Һ�У��ٽ�������Һ����ȥˮ�㣬�õ��л��㡣
�Իش��������⣺
��1����������ƿB�����Լ�__��Ȼ��ͨ������A��������__��
��2��д���Ʊ����������Ļ�ѧ����ʽ__��
��3������A��������__��Ũ�����������__������C��������__��
��4����Ӧ�����õ��Ҵ��ǹ����ģ���Ŀ����__��
��5�����м��뱥��̼������Һ������__����������������εؼ��뱥��̼���Ƶ�ԭ����__��
��6���Ӣ��з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ��뱥���Ȼ�����Һ�����__���ټ�����ˮ�����ƣ�Ȼ����������ռ�77.2�����֣��Եõ���������������9.2g�������ʵ�����������������IJ���Ϊ__��д������ı���ʽ����
���𰸡��Ҵ� Ũ���ᡢ���� CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ��Һ©�� ��������ˮ�� ���� ������������Ӧ����������У��������������ʣ� ���ջӷ�������������Ҵ������������������ܽ�ȱ��ڷֲ����� ��ֹ��Ӧ���ȣ��¶����ߣ��������������IJ��� �Ҵ�
CH3COOCH2CH3+H2O ��Һ©�� ��������ˮ�� ���� ������������Ӧ����������У��������������ʣ� ���ջӷ�������������Ҵ������������������ܽ�ȱ��ڷֲ����� ��ֹ��Ӧ���ȣ��¶����ߣ��������������IJ��� �Ҵ� ![]() ��100%
��100%
��������
��1���Ʊ���������ʱ�����ȼ����Ҵ����ټ�Ũ��������ᣬ��Ϊ�����ܶȽϴ����ȼ�Ũ�����ټ��Ҵ���ų��������ȣ����������ܼ�ʱɢʧ�������Һ��ɽ�������Σ�գ������ȼ��Ҵ��ټ�Ũ����������ɢ�ȣ�����Һ��ɽ�������ټ������
��2��������Ҵ���Ũ����Ĵ��¼��ȿɷ�Ӧ����������������Ӧ����ʽΪ��CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
��3������ͼ��֪������A�Ƿ�Һ©����Ũ�����Ƿ�Ӧ�Ĵ���������֮�⣬Ũ��������ˮ�ԣ����պ�ƽ���������ƶ����������������������ɣ��ʻ�����ˮ�������ã�����C�������ܣ���Ҫ�������������������壻
��4���Ҵ������ɴٽ�ƽ�����������������ķ����ƶ����������������������ɣ���������ת���ʣ�
��5������̼���ƿ��������Ҵ����к����ᣬ���������������ܽ�ȣ����������������ķֲ㣻����̼���������ᷴӦ����ȣ��¶����ᵼ�����������ӷ������²����½�������Ҫ��������������εؼ��뱥��̼���ƣ�
��6������CaCl2�����Ҵ��γ�������ˮ��CaCl2��6C2H5OH�����Լ���CaCl2���Գ�ȥ�Ҵ���
�����Ҵ������������������������۲�������������㣬���������Ϊ12mL��1.05g/mL��96%�����ʵ���Ϊ![]() �������������������۲���Ϊ
�������������������۲���Ϊ![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ�������й�˵����ȷ����
A.60�˵�����������ǻ������ȼ������O2������Ϊ2NA
B.5.8g��ʯ�ࣨ2CaSO4��H2O�����еĽᾧˮ������Ϊ0.04NA
C.��4.6g�Ҵ���ȫ���������ȩ��ת�Ƶ�����Ϊ0.1NA
D.ʵ������ȡ���������ж��֣���ȡ1molO2ת�Ƶ���������4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����������Ƽ�ȩ(NaHSO2��HCHO��2H2O)�IJ������£�����ƿ�е�����������Һͨ��SO2�Ƶ�NaHSO3����װ��A�е����ܻ�����Ƥ�����ټ���п�ۺͼ�ȩ��Һ����80��90���£���ӦԼ3h����ȴ�����£����ˣ�����Һ�����������������Ũ������ȴ�ᾧ������˵��������ǣ� ��
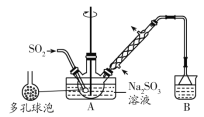
A.�����������ƹ����70%��������ȡ������������
B.������ݵ�������������������Һ�ĽӴ������ʹ��Ӧ��ֽ���
C.װ��B���Լ�������NaOH��Na2CO3��Һ
D.װ��A�пɲ�����ԡ��ɳԡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����������ȼ�ϵ�أ���������Һ�����ԣ���֪��CH2O��n��̼�Ļ��ϼ�Ϊ0�ۣ��йظõ�ص�˵����ȷ����

A. �ŵ�����������Һ��pH����
B. ������22gCO2ʱ��������Ǩ�����ӵ����ʵ���Ϊ4mol
C. ����22gCO2ʱ��Ĥ�����Һ�������仯Ϊ��89g
D. ���������·����������Ϊ��a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ��Ľṹ���û�ѧ��������������⡣
�� | |||||||||||||||||
�� | �� | �� | |||||||||||||||
�� | �� | �� | �� | �� | |||||||||||||
��1�������б�ŵ�Ԫ���л�ѧ��������õģ���ԭ�ӽṹʾ��ͼΪ__������ݰ���ԭ�Ӹ�����1��1�γɵĻ������к��еĻ�ѧ����___��
��2��������γɵ��������Ŀռ乹��Ϊ__�����˻��������ĵ��ʻ����һ����ļ���ƿ���ܷ����ڹ�����һ��ʱ��۲쵽��������__��
��3���ɢ��γɵĵ��ʵĵ���ʽΪ__������ߵ���ͼ��γɵĻ�����ĵ���ʽΪ__��
��4���������������Ӧ��ˮ����Ļ�ѧʽ��___���ٷֱ���ܡ����γɵļ�������ȶ�����ǿ������˳����__��
��5���ܡ��ޡ�������Ԫ�ص�ԭ���γɵļ������а뾶�ɴ�С��˳����__��
��6�����������յĻ�ѧ���ۣ����һ��ʵ�飬֤���ߵķǽ����ԱȢ�ǿ__���û�ѧ����ʽ��ʾ����Ӧԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ�¡�ͬѹ�£��������NH3��CH4�������壬�����й�˵��������ǣ���
A.����������Ŀ��ͬB.����֮��Ϊ16��17
C.������ԭ�����ʵ���֮��Ϊ3��4D.�ܶ�֮��Ϊ17��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ�ɫ���壬������������Ӱ�������͵�ز��ϵȡ�
ʵ�����Ʊ������������ⶨ����Fe2+��C2O42�����ʵ���֮��ȷ���䴿�ȣ��������£�
������ȡһ�����������������[(NH4)2Fe(SO4)2]���ձ��У�������ˮ��ϡ���ᣬ�����ܽ⣬�ټӱ���H2C2O4��Һ�����ȷ��������ӣ���ȴ�����ˡ�ϴ�ӡ����ɣ��û�ɫ���塣
������ȡm g�����Ƶõľ�������ƿ�У��������ϡ����ʹ���ܽ⣬70��ˮԡ���ȣ���c mol��L1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һv1 mL����������������KMnO4����Ӧ����
���������ζ������Һ�м������п�ۺ�ϡ���ᣬ��У�����Ӧ��ȫ�����ˣ���c mol��L1 KMnO4��Һ�ζ���Һ���յ㣬����KMnO4��Һv2 mL��
�����ظ�����ʵ��3�Σ����㡣
��֪���������������ᡣ
����pH>4ʱ��Fe2+�ױ�O2������
�������������£�KMnO4��Һ�Ļ�ԭ����Ϊ������ɫ��Mn2+��
�ش��������⣺
��1�����м���ϡ�����Ŀ����__________________________��_______________________��
��2��������KMnO4��Һ��Ӧ������_____________��____________��
��3�����м������п�۽���Fe3+��ȫ��ԭΪFe2+����δ��������п�ۣ�������KMnO4��Һ�����V ______v2 mL������������������������������
��4�����У��ζ�ʱ��Ӧ�����ӷ���ʽ��__________________________,�ζ�ʱKMnO4��Һװ��__________________��������������,�ζ��յ������_________________________________________��
��5��m g�����Ƶõľ����У�Fe2+��C2O42�����ʵ���֮����____________________���ú�v1�� v2�ļ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������I1��ָ��̬ԭ��X(g)���ڻ�̬ʱ��ʧȥһ�����ӳ�Ϊ��̬������X��(g)�������������ͼ�Dz���Ԫ��ԭ�ӵĵ�һ������I1��ԭ�������仯������ͼ(����12����17��Ԫ�ص��й�����ȱʧ)��
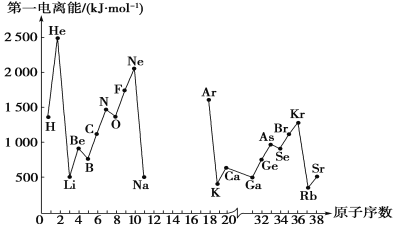
(1)���������ͼ��ͬ����Ԫ�ص�һ�����ܵı仯���ɣ��ƶ�Na��ArԪ���У�Al�ĵ�һ�����ܵĴ�С��ΧΪ____<Al<__��(��Ԫ�ط���)
(2)����ͼ������֪��ͬһ����Ԫ��ԭ�ӵĵ�һ������I1�仯������_____��
(3)��ͼ�е�һ��������С��Ԫ�������ڱ��е�λ���ǵ�________����________�壻
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����װ�[(CH3)2NH]��ˮ�е����백���ƣ�![]() �������£���0. l00mol/L��HCl�ֱ�ζ�20. 00mLŨ�Ⱦ�Ϊ0.l00mol/L��NaOH�Ͷ��װ���Һ����õζ���������Һ�ĵ絼�ʱ仯������ͼ��ʾ������˵����ȷ����
�������£���0. l00mol/L��HCl�ֱ�ζ�20. 00mLŨ�Ⱦ�Ϊ0.l00mol/L��NaOH�Ͷ��װ���Һ����õζ���������Һ�ĵ絼�ʱ仯������ͼ��ʾ������˵����ȷ����
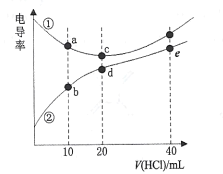
A.b����Һ��![]()
B.d����Һ��![]()
C.e����Һ�У�![]()
D.a��b ��c��d���Ӧ����Һ�У�ˮ�ĵ���̶ȣ�![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com