
【题目】同温、同压下,等体积的NH3和CH4两种气体,下列有关说法错误的是()
A.所含分子数目相同B.质量之比为16:17
C.所含氢原子物质的量之比为3:4D.密度之比为17:16
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,控制条件改变0.1mol·L-1二元弱酸H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4-、C2O42-的物质的量分数δ(X)随pOH的变化如图所示。已知pOH=-lgc(OH-),![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
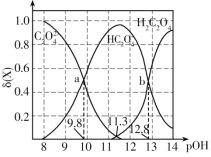
A.反应H2C2O4+C2O42-![]() 2HC2O4-的平衡常数的值为103
2HC2O4-的平衡常数的值为103
B.若升高温度,a点移动趋势向右
C.pH=3时,![]() =100.6:1
=100.6:1
D.物质的量浓度均为0.1mol·L-1的Na2C2O4、NaHC2O4混合溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池----锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法错误的是( )
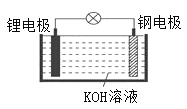
A.锂为负极,钢为正极
B.工作时负极的电极反应式:Li-e-=Li+
C.工作时OH-向锂电极移动
D.放电时电子的流向:锂电极→KOH溶液→钢电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体。某同学采用12.0mL96%密度为1.05g/mL的乙酸、23mL95%密度为0.75g/mL的乙醇、12.0mL浓硫酸、饱和Na2CO3溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.2 |

①先向蒸馏烧瓶B中加入试剂__,然后通过仪器A慢慢加入__;
②加热保持油浴温度为135~145℃,至不再有液体流出后,停止加热;
③取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,再将混合物分液,弃去水层,得到有机层。
试回答下列问题:
(1)①蒸馏烧瓶B加入试剂__,然后通过仪器A慢慢加入__。
(2)写出制备乙酸乙酯的化学方程式__。
(3)仪器A的名称是__;浓硫酸的作用是__;仪器C的作用是__。
(4)反应中所用的乙醇是过量的,其目的是__。
(5)③中加入饱和碳酸钠溶液的作用__,分批、少量、多次地加入饱和碳酸钠的原因是__。
(6)从③中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__,再加入无水硫酸钠,然后进行蒸馏,收集77.2℃的馏分,以得到纯净的乙酸乙酯9.2g,计算此实验中生成乙酸乙酯的产率为__(写出计算的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
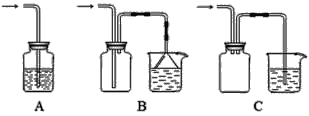
【题目】Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
(1)下列装置适合作尾气吸收的是________(填序号)。
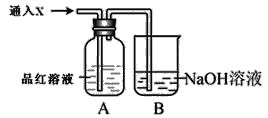
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是_____(至少填两种)如果要证明X是SO2气体,接下来的操作是______
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,______后,再滴入几滴植物油;
(2)选择装置_______(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
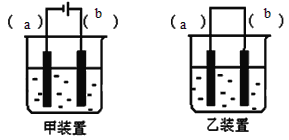
(3)在你选择的装置上标明电极材料分别为__________、________
(4)实验中可在______看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
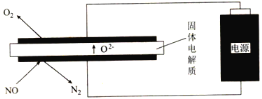
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:①![]() ΔH1=-566.0 kJ·mol-1②
ΔH1=-566.0 kJ·mol-1②![]() ΔH2=-116.5 kJ·mol-1③
ΔH2=-116.5 kJ·mol-1③![]() ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
ΔH3=+180.5 kJ·mol-1,废气中NO2 与CO 转化成无污染气体的热化学方程式为____。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1∶2、1∶1.5、3∶1时,NO脱除率随温度变化的曲线如图所示。

①曲线a中,NO的起始浓度为6×10-4mg·m-3,从X点到Y点经过10 s,则该时间段内NO的脱除速率为___________mg· m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是___,其理由是___。
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。
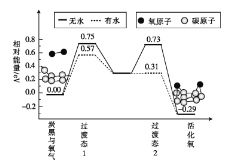
无水情况下,一个氧分子的活化能为__ ,容易活化氧分子的条件是___(填“有水”或“无水”)。
(4)利用反应![]() 构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
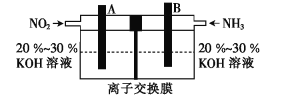
①B极的电极反应式为___。
②若反应转移1.2 mol电子,A极生成N2的体积为___L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成与开发大量自然界并不存在的新物质、新材料,并为人类服务是现代化学的重要任务。请结合所学知识回答下列问题:
(1)沙滩上沙粒的主要成分是____。工业上可用沙粒的主要成分与纯碱在高温下反应制备Na2SiO3,该反应的化学方程式为____。
(2)氯气溶于水能杀菌消毒,在新制氯水中滴入紫色石蕊试液的现象是___,该现象说明氯水中含有_______(填化学式或离子符号)。
(3)直接用氯气作漂白剂,难以保存,效果不理想。经过多年的实验、改进,目前常用的是漂白粉。工业制取漂白粉的化学方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com