
ЁОЬтФПЁПКЯГЩгыПЊЗЂДѓСПздШЛНчВЂВЛДцдкЕФаТЮяжЪЁЂаТВФСЯЃЌВЂЮЊШЫРрЗўЮёЪЧЯжДњЛЏбЇЕФживЊШЮЮёЁЃЧыНсКЯЫљбЇжЊЪЖЛиД№ЯТСаЮЪЬтЃК
(1)ЩГЬВЩЯЩГСЃЕФжївЊГЩЗжЪЧ____ЁЃЙЄвЕЩЯПЩгУЩГСЃЕФжївЊГЩЗжгыДПМюдкИпЮТЯТЗДгІжЦБИNa2SiO3ЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____ЁЃ
(2)ТШЦјШмгкЫЎФмЩБОњЯћЖОЃЌдкаТжЦТШЫЎжаЕЮШызЯЩЋЪЏШяЪдвКЕФЯжЯѓЪЧ___ЃЌИУЯжЯѓЫЕУїТШЫЎжаКЌга_______(ЬюЛЏбЇЪНЛђРызгЗћКХ)ЁЃ
(3)жБНггУТШЦјзїЦЏАзМСЃЌФбвдБЃДцЃЌаЇЙћВЛРэЯыЁЃОЙ§ЖрФъЕФЪЕбщЁЂИФНјЃЌФПЧАГЃгУЕФЪЧЦЏАзЗлЁЃЙЄвЕжЦШЁЦЏАзЗлЕФЛЏбЇЗНГЬЪНЮЊ__ЁЃ
ЁОД№АИЁПSiO2 SiO2 + Na2CO3 ![]() Na2SiO3 + CO2Ёќ ЯШБфКьКѓЭЪЩЋ H+ЁЂClO-ЛђHClOЁЂHCl 2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O
Na2SiO3 + CO2Ёќ ЯШБфКьКѓЭЪЩЋ H+ЁЂClO-ЛђHClOЁЂHCl 2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2O
ЁОНтЮіЁП
ИљОнSiO2ЕФаджЪМАЙшЫсбЮЙЄвЕНтЬтЃЛИљОнТШЦјгыЫЎЗДгІЕФВњЮяЗжЮіТШЫЎЕФГЩЗжМАаджЪЃЛИљОнТШЦјгыМюЗДгІЕФдРэЗжЮіЁЃ
(1)ЩГЬВЩЯЩГСЃЕФжївЊГЩЗжЪЧSiO2ЃЛSiO2гыДПМюдкИпЮТЯТЗДгІжЦБИNa2SiO3ЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊSiO2 + Na2CO3![]() Na2SiO3 + CO2ЁќЃЛ
Na2SiO3 + CO2ЁќЃЛ
(2)ТШЦјШмгкЫЎФмгыЫЎЗДгІЩњГЩHClКЭHClOЃЌЦфжаHClOгаЧПбѕЛЏЃЌдђдкаТжЦТШЫЎжаЕЮШызЯЩЋЪЏШяЪдвКЕФЯжЯѓЪЧЯШБфКьКѓЭЪЩЋЃЌИУЯжЯѓЫЕУїТШЫЎжаКЌгаH+ЁЂClO-ЛђHClOЁЂHClЃЛ
(3)ЙЄвЕЩЯРћгУCl2КЭЯћЪЏЛвЛьКЯжЦШЁЦЏАзЗлЕФЛЏбЇЗНГЬЪНЮЊ2Cl2+2Ca(OH)2 =CaCl2 + Ca(ClO)2 + 2H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЭЌЮТЁЂЭЌбЙЯТЃЌЕШЬхЛ§ЕФNH3КЭCH4СНжжЦјЬхЃЌЯТСагаЙиЫЕЗЈДэЮѓЕФЪЧЃЈЃЉ
A.ЫљКЌЗжзгЪ§ФПЯрЭЌB.жЪСПжЎБШЮЊ16ЃК17
C.ЫљКЌЧтдзгЮяжЪЕФСПжЎБШЮЊ3ЃК4D.УмЖШжЎБШЮЊ17ЃК16
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђКЌга4 mol HNO3КЭ1 mol H2SO4ЕФЛьКЯШмвКжаж№НЅМгШыЬњЗлжСЙ§СПЃЌШмвКжаН№ЪєбєРызгaЁЂbгыЫљМгЬњЗлЕФЮяжЪЕФСПЕФЙиЯЕШчЭМЫљЪО(вбжЊЯЁЯѕЫсЕФЛЙдВњЮяжЛгаNO)ЁЃ
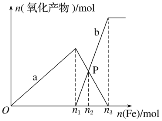
(1)bБэЪОЕФЙиЯЕЧњЯп_______(ЬюРызгЗћКХ)
(2)n1ЃН______
(3)PЕуЪБЃЌn(Fe2ЃЋ)ЃН______mol
(4)ЯђPЕуШмвКжаМгШыЭЗлЃЌзюЖрПЩШмНт________g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
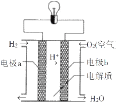
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщЮЊСЫЬНОПТСЕчМЋдкЕчГижаЕФзїгУЃЌЩшМЦВЂНјааСЫвдЪЕбщНсЙћМЧТМШчЯТ:
БрКХ | ЕчМЋВФСЯ | ЕчНтжЪШмвК | ЕчСїБэжИеыЦЋзЊЗНЯђ |
1 | AlЁЂCu | ЯЁбЮЫс | ЦЋЯђCu |
2 | AlЁЂCЃЈЪЏФЋЃЉ | ЯЁбЮЫс | ЦЋЯђЪЏФЋ |
ЛиД№ЯТСаЃЈ1ЃЉЁЂЃЈ2ЃЉаЁЬт:
ЂХЪЕбщ1жаAlзїЕФЕчМЋЮЊ____(ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ЃЌCuзїЕФЕчМЋЮЊ____(ЬюЁАе§МЋ"ЛђЁАИКМЋЁБ)ЁЃ
ЂЦЪЕбщ2ЙлВьЕНC(ЪЏФЋ)АєЩЯВњЩњЕФЯжЯѓЪЧ____,ИКМЋЕФЕчМЋЗДгІЪНЮЊ____.ШчЭМЪЧЕчНтжЪЮЊЯЁСђЫсШмвКЕФЧтбѕШМСЯЕчГиЁЃИУЕчГиЕФЕчзгДгЕчМЋ____ОЙ§ЕМЯпСїЯђЕчМЋ____(ЬюaЛђb)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўМзАЗ[(CH3)2NH]дкЫЎжаЕчРыгыАБЯрЫЦЃЌ![]() ЁЃГЃЮТЯТЃЌгУ0. l00mol/LЕФHClЗжБ№ЕЮЖЈ20. 00mLХЈЖШОљЮЊ0.l00mol/LЕФNaOHКЭЖўМзАЗШмвКЃЌВтЕУЕЮЖЈЙ§ГЬжаШмвКЕФЕчЕМТЪБфЛЏЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЁЃГЃЮТЯТЃЌгУ0. l00mol/LЕФHClЗжБ№ЕЮЖЈ20. 00mLХЈЖШОљЮЊ0.l00mol/LЕФNaOHКЭЖўМзАЗШмвКЃЌВтЕУЕЮЖЈЙ§ГЬжаШмвКЕФЕчЕМТЪБфЛЏЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
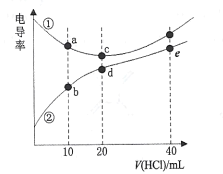
A.bЕуШмвКЃК![]()
B.dЕуШмвКЃК![]()
C.eЕуШмвКжаЃК![]()
D.aЁЂb ЁЂcЁЂdЕуЖдгІЕФШмвКжаЃЌЫЎЕФЕчРыГЬЖШЃК![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУжЪСПЗжЪ§ЮЊ36.5%ЕФХЈбЮЫсЃЈУмЖШЮЊ1.16gcmЉ3ЃЉХфжЦГЩ1molLЉ1ЕФЯЁбЮЫсЁЃЯжЪЕбщЪвНіашвЊетжжбЮЫс220mLЃЌЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉХфжЦЯЁбЮЫсЪБЃЌгІбЁгУШнСПЮЊ___ЕФШнСПЦПЁЃ
ЃЈ2ЃЉОМЦЫуашвЊ___mLХЈбЮЫсЃЌдкСПШЁЪБвЫбЁгУЯТСаСПЭВжаЕФ___ЁЃ
AЃЎ5mL BЃЎ10mL CЃЎ25mL DЃЎ50mL
ЃЈ3ЃЉДгЯТСавЧЦїжаЃЌВЛЛсгУЕНЕФЪЧ___ЃЈбЁађКХЃЉЁЃ
ЂйСПЭВ ЂкВЃСЇАє ЂлвЉГз ЂмШнСПЦП ЂнЩеБ ЂоЬЈГг ЂпНКЭЗЕЮЙм ЂрЯИПкЪдМСЦП ЂсБъЧЉжН
ЃЈ4ЃЉШєЪЕбщЙ§ГЬгіЕНЯТСаЧщПіЃЌЖдбЮЫсЕФЮяжЪЕФСПХЈЖШгаКЮгАЯьЃЈЬюЁАЦЋИпЁБЁЂЁАЦЋЕЭЁБЛђЁАВЛБфЁБЃЉЁЃ
ЂйШнСПЦПЯДЕгКѓШдЩйаэеєСѓЫЎЃЌ___ЃЛЂкЮДОРфШДНЋШмвКзЂШыШнСПЦПжаЃЌ___ЃЛ
ЂлвЁдШКѓЗЂЯжвКУцЯТНЕдйМгЫЎЃЌ___ЃЛЂмЖЈШнЪБИЉЪгЙлВьвКУцЃЌ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊFeSШмгкбЮЫсжаЃЌЩњГЩFeCl2КЭH2SЦјЬхЁЃЯжНЋ100mL2.0mol/LЕФбЮЫсМгШыЕНвЛЖЈСПЕФFeSЙЬЬхжаЃЌвджЦБИH2SЦјЬхЁЃЕБбЮЫсЭъШЋЗДгІКѓМйЖЈШмвКЬхЛ§ВЛБфЁЃ
ЪдМЦЫуЃК(1)ПЩЪеМЏЕНЕФH2SЦјЬхдкБъзМзДПіЯТЕФЬхЛ§___________________;
(2)ЗДгІКѓШмвКжаFeCl2ЕФЮяжЪЕФСПХЈЖШ_________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТСЬМЫсУО [AlaMgb(CO3)c(OH)deH2O] гУгкжЮСЦТ§адЮИбзЁЃГЦШЁ3.01 gТСЬМЫсУОбљЦЗЃЌШмгк50 mL 2 molL -1ЕФбЮЫс(Й§СП)ЃЌЪеМЏЕНЦјЬх112 mL(БъзМзДПі)ЃЛЭљЫљЕУШмвКжаМгШы40 mL 3 molL-1ЕФNaOHШмвКЃЌЙ§ТЫЃЌНЋЫљЕУГСЕэЯДЕгЁЂИЩдяЁЂГЦСПЕУЙЬЬх1.74 gЃЛдйНЋТЫвКЯЁЪЭЕН100 mLЃЌВтЕУШмвКжаOHЁЅЕФХЈЖШЮЊ0.1 molL -1ЁЃгЩМЦЫуПЩЕУeЕФжЕЮЊ
A. 4B. 5C. 7D. 8
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШХўИёРзЃЈclopidogrelЃЉЪЧвЛжжгУгквжжЦбЊаЁАхОлМЏЕФвЉЮяЃЌвд2-ТШБНМзШЉЮЊдСЯЕФКЯГЩТЗЯпШчЯТЃК

ЃЈ1ЃЉЗжзгCжаФмЭХУћГЦЮЊ__________ЃЌТШпСИёРзЕФЗжзгЪНЮЊ____________ЁЃ
ЃЈ2ЃЉXЕФНсЙЙМђЪНЮЊ_____________ЁЃ
ЃЈ3ЃЉСНЗжзгCПЩдквЛЖЈЬѕМўЯТЗДгІЃЌЩњГЩЕФгаЛњВњЮяжаКЌга3ИіСљдЊЛЗЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃК_____________________ЁЃ
ЃЈ4ЃЉЮяжЪDЕФФГжжЭЌЗжвьЙЙЬхGТњзувдЯТЬѕМўЃК
Ђй БНЛЗЩЯгаСНИіШЁДњЛљЃЌЧвЦфжавЛИіШЁДњЛљВЛКЌЬМдзгЃЛЂк гыDжаЕФЙйФмЭХЯрЭЌЃЛЂлGФмЗЂЩњвјОЕЗДгІЃЛдђЗћКЯЬѕМўЕФGга_______жжЁЃ
ЃЈ5ЃЉвбжЊЃК![]()
дкЯТСаЗНПђФкаДГігЩввЯЉ-МзДМЮЊгаЛњдСЯжЦБИЛЏКЯЮя![]() ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉЃЌВЂБъГіУПВНЖдгІЕФЗДгІРраЭЁЃ_____________________ЪОР§ШчЯТЃК
ЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉЃЌВЂБъГіУПВНЖдгІЕФЗДгІРраЭЁЃ_____________________ЪОР§ШчЯТЃК
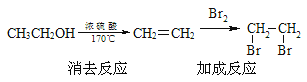
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com