
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
【答案】250mL 21.6 C ③⑥ 不变 偏高 偏低 偏高
【解析】
(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL;
(2)浓盐酸的物质的量浓度为c=![]() ,根据溶液稀释定律C浓V浓=C稀V稀可计算盐酸体积;根据“大而近”的原则选择量筒;
,根据溶液稀释定律C浓V浓=C稀V稀可计算盐酸体积;根据“大而近”的原则选择量筒;
(3)溶液的配制中用到量筒、玻璃棒、259ml容量瓶、烧杯、台秤、胶头滴管、细口试剂瓶、标签纸;
(4)依据C=![]() 进行误差分析,分析不当操作对溶质的物质的量和溶液的体积的影响。
进行误差分析,分析不当操作对溶质的物质的量和溶液的体积的影响。
(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL,现在需要这种盐酸220mL,故应选用250mL容量瓶,故答案为:250;
(2)浓盐酸的物质的量浓度为c=![]() =
=![]() =11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×V×10—3L=1mol/L×250×10—3L,解得V=21.6mL;根据“大而近”的原则,根据需要量取的浓盐酸的体积为21.6mL来选择合适的量筒,应选择25mL量筒,故答案为:21.6;C;
=11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×V×10—3L=1mol/L×250×10—3L,解得V=21.6mL;根据“大而近”的原则,根据需要量取的浓盐酸的体积为21.6mL来选择合适的量筒,应选择25mL量筒,故答案为:21.6;C;
(3)由溶液的配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,溶液的配制中用到量筒、玻璃棒、259ml容量瓶、烧杯、台秤、胶头滴管、细口试剂瓶、标签纸,用不到药匙、台秤,故答案为:③⑥;
(4)①容量瓶中有少量蒸馏水,未干燥即将溶液转入,对溶质的物质的量和溶液的体积都不会产生影响,不影响溶液浓度,故答案为:不变;
②溶液未经冷却即注入容量瓶,冷却后溶液体积缩小,导致浓度偏高,故答案为:偏高;
③摇匀后,容量瓶的壁上会残留部分溶液,液面会低于刻度线,若再加水溶液体积增大,导致浓度偏低,故答案为:偏低;
④定容时俯视观察液面,导致溶液体积偏小,所配溶液浓度偏高,故答案为:偏高。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
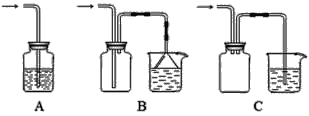
(1)下列装置适合作尾气吸收的是________(填序号)。
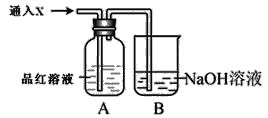
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是_____(至少填两种)如果要证明X是SO2气体,接下来的操作是______
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,______后,再滴入几滴植物油;
(2)选择装置_______(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
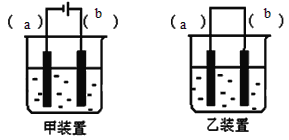
(3)在你选择的装置上标明电极材料分别为__________、________
(4)实验中可在______看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
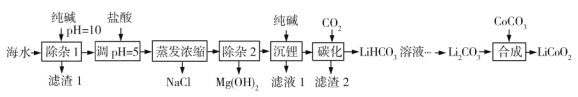
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
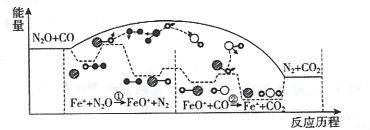
A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成与开发大量自然界并不存在的新物质、新材料,并为人类服务是现代化学的重要任务。请结合所学知识回答下列问题:
(1)沙滩上沙粒的主要成分是____。工业上可用沙粒的主要成分与纯碱在高温下反应制备Na2SiO3,该反应的化学方程式为____。
(2)氯气溶于水能杀菌消毒,在新制氯水中滴入紫色石蕊试液的现象是___,该现象说明氯水中含有_______(填化学式或离子符号)。
(3)直接用氯气作漂白剂,难以保存,效果不理想。经过多年的实验、改进,目前常用的是漂白粉。工业制取漂白粉的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
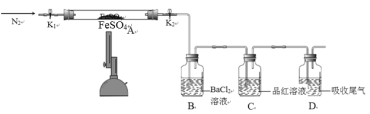
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3![]() 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
A. ②③B. ③④C. ①②D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
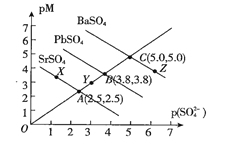
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com