
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
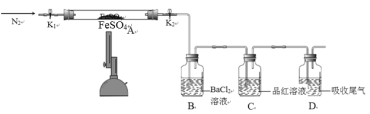
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
【答案】排尽装置内的空气,防止干扰实验 有白色沉淀生成 SO2 制作油漆或涂料 2FeSO4![]() Fe2O3 + SO2↑+SO3↑
Fe2O3 + SO2↑+SO3↑
【解析】
FeSO4易被空气中氧气氧化,需要在无氧环境中加热分解,所得固体产物红色粉末为Fe2O3,BaCl2溶液中有白色沉淀生成说明有SO3生成,品红褪色说明有SO2气体生成,结合电子守恒和原子守恒写出发生反应的化学方程式。
(1) 为避免亚铁被氧化,加热前通入N2的目的是排尽装置内的空气,防止干扰实验;
(2)实验过程中可观察到装置B中的现象为有白色沉淀生成,说明有SO3生成;C中观察到品红溶液褪色,则可证明混合气体中含有的物质是SO2;
(3)反应后A中残留红色粉末为Fe2O3,可制作油漆或涂料;
(4) 硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,方程式为2FeSO4![]() Fe2O3 + SO2↑+SO3↑。
Fe2O3 + SO2↑+SO3↑。


科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)═CO(g)+H2(g)△H=+131kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣394kJ/mol
CO(g)+![]() O2(g)═CO2(g)△H=﹣283kJ/mol
O2(g)═CO2(g)△H=﹣283kJ/mol
则CO(g)+H2O(g)![]() H2(g)+CO2(g)△H=____________.
H2(g)+CO2(g)△H=____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用干燥的H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法不正确的是
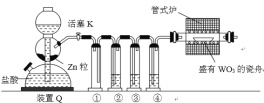
A.①的作用是防倒吸
B.②、③、④中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
C.管式炉中发生反应的化学方程式为:3H2+ WO3![]() W+3H2O
W+3H2O
D.装置Q不能用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电子式:
NaCl____________;HCl_____________
(2)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_____________,呈两性的氢氧化物是_______________。半径最大的原子是__________,氢化物最稳定的元素是___________。
(3)硫元素位于元素周期表中______周期_______族,气态氢化物的化学式是____________,最高价氧化物对应水化物的化学式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-l、-764.5kJ·mol-l。则反应I:CO(g)+2H2(g)=CH3OH(g)△H=___
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
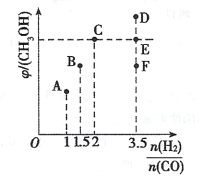
①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___(填“增大”、“减小”或“不变”)。
②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。
③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。
(3)在一容积可变的密闭容器中充有10molCO和20molH2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。
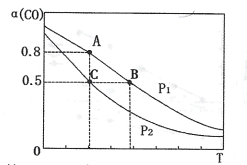
①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。
②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A. 甘氨酸和氯乙烯都能通过聚合反应生成高分子化合物
B. 检测淀粉是否完全水解,向水解液中滴加碘水
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的物质的量不相同
)完全燃烧,消耗氧气的物质的量不相同
D. 乙酸和葡萄糖都能与新制的氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。
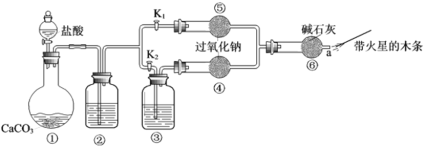
(装置分析)
(1)装置①中反应的化学方程式是___________。
(2)装置②中的试剂是___________(填序号)。装置③中的试剂是___________.
a.饱和![]() 溶液 b.饱和
溶液 b.饱和![]() 溶液 c.浓
溶液 c.浓![]()
(进行实验)
步骤1:打开弹簧夹![]() ,关闭
,关闭![]() ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹![]() ,关闭
,关闭![]() ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。
(3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是__________;__________。
(4)过氧化钠跟二氧化碳反应的化学方程式是________
(实验反思)
(5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应。”其理由是_______。
(6)需要补充的实验操作是:取⑤中反应后的少量固体,_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com