
【题目】(1)写出下列物质的电子式:
NaCl____________;HCl_____________
(2)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_____________,呈两性的氢氧化物是_______________。半径最大的原子是__________,氢化物最稳定的元素是___________。
(3)硫元素位于元素周期表中______周期_______族,气态氢化物的化学式是____________,最高价氧化物对应水化物的化学式_________________
【答案】![]()
![]() HClO4 NaOH Al(OH)3 Na Cl 第三 ⅥA H2S H2SO4
HClO4 NaOH Al(OH)3 Na Cl 第三 ⅥA H2S H2SO4
【解析】
(1)NaCl是离子化合物,Na+和Cl-形成离子键,其电子式为![]() ,HCl是共价化合物,H和Cl形成共价键,其电子式为
,HCl是共价化合物,H和Cl形成共价键,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)同周期元素从左往右原子半径依次减小(稀有气体除外),金属性依次减弱,非金属性依次增强,金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价氧化物对应水化物的酸性越强,气态氢化物越稳定,因此第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3,半径最大的原子是Na,氢化物最稳定的元素是Cl,故答案为:HClO4;NaOH;Al(OH)3;Na;Cl;
(3)S是第16号元素,位于元素周期表第三周期第ⅥA族,气态氢化物为H2S,最高价氧化物对应水化物为硫酸,化学式为H2SO4,故答案为:第三;ⅥA;H2S;H2SO4。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2+O2![]() 2SO3,在一定温度下的定容容器中进行,下列说法正确的是
2SO3,在一定温度下的定容容器中进行,下列说法正确的是
A.反应达到限度时,各反应物和生成物的浓度之比等于化学计量数之比
B.反应达到限度时,SO2将全部转化为SO3
C.反应达到限度时,O2物质的量不再改变
D.反应达到限度时,v(正反应)=v(逆反应)=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】救灾物资中的一瓶“84消毒液”的包装说明上有如下信息:含25%NaClO(次氯酸钠)、1000 mL、密度1.19 g/cm3,稀释100倍(体积比)后使用。
请回答下列问题:
(1)上述“84消毒液”的物质的量浓度为___mol/L。
(2)该同学取100 mL上述“84消毒液”,稀释后用于消毒,稀释100倍后的溶液中c(Na+)=___mol/L(假设稀释后溶液密度为1.0 g/cm3),该消毒液长时间放置在空气中能吸收标准状况下CO2的体积为____L。(已知:酸性:H2CO3> HClO> HCO3-)
(3)灾区志愿者根据上述“84消毒液”的包装说明,欲用NaClO固体(NaClO易吸收空气中的H2O、CO2)配制480 mL含25%NaClO的消毒液。下列说法正确的是___。
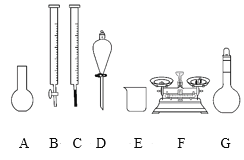
a.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
b.容量瓶用蒸馏水洗净后,要烘干才能用于溶液的配制
c.利用购买的商品NaClO来配制可能会导致结果偏低
d.需要NaClO固体的质量为143g
(4)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN-bmg/L,现用ClO2将CN-氧化,只生成两种无毒气体,其离子反应方程式为_____,处理100 m3这种污水,至少需要ClO2_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
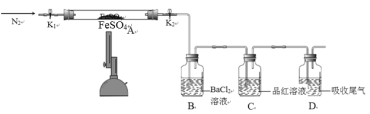
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
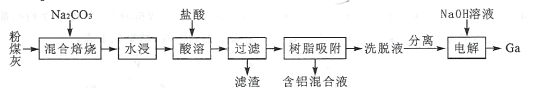
回答下列问题:
(1)焙烧前,应将粉煤灰与纯碱粉末充分混合,其原因是____;混合焙烧时,Al2O3、Ga2O3均发生类似于SiO2的反应,试写出Ga2O3在此过程中发生反应的化学方程式:____。
(2)滤渣的成分是____ ;含铝混合液中除了大量A13+之外,还有Fe3+和少量Mg2+,由混合液制取纯净Al(OH)3的实验方案是_____。
(3)洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)= l×l0-5mol·L-l]时,Ga3+浓度至少为_____mol·L-l才会开始沉淀。(已知:![]() 。)
。)
(4)电解过程中,Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电,则电解方程式为____;电解过程中需要保持溶液为pH=11以上的原因是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。
(1)该溶液的物质的量浓度________________
(2)该溶液的质量分数_________________________
Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题:
溶质的质量分数 | 溶液的密度(g·cm-3) | |
第一份溶液 | w1 | ρ1 |
第二份溶液 | w2 | ρ2 |
(1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示)
(2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3___w4;若ρ1<ρ2,w3______w4(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为___。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表的___区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为___(用元素符号表示),苯酚中碳原子的杂化轨道类型为___。
(4)铁元素能于CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe(CO)5分子中含___molσ键,与CO互为等电子体的一种离子的化学式为___。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
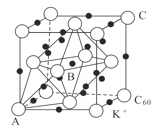
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为___,晶胞参数为428pm,则晶体密度为___g/cm3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组的同学利用如图所示装置探究二氧化硫气体的性质。请回答:
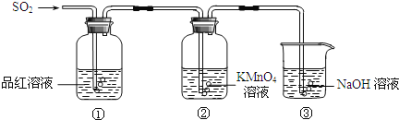
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是____。
(2)当观察到②中溶液颜色变浅时,①中的现象是____。
(3)装置③的作用是___。
(4)①中的现象说明二氧化硫具有的性质是___。
(5)②中的现象说明二氧化硫具有的性质是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com