
【题目】我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
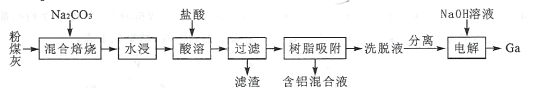
回答下列问题:
(1)焙烧前,应将粉煤灰与纯碱粉末充分混合,其原因是____;混合焙烧时,Al2O3、Ga2O3均发生类似于SiO2的反应,试写出Ga2O3在此过程中发生反应的化学方程式:____。
(2)滤渣的成分是____ ;含铝混合液中除了大量A13+之外,还有Fe3+和少量Mg2+,由混合液制取纯净Al(OH)3的实验方案是_____。
(3)洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)= l×l0-5mol·L-l]时,Ga3+浓度至少为_____mol·L-l才会开始沉淀。(已知:![]() 。)
。)
(4)电解过程中,Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电,则电解方程式为____;电解过程中需要保持溶液为pH=11以上的原因是 ___。
【答案】增大反应物接触面积,加快化学反应速率 Ga2O3+Na2CO3![]() 2NaGaO2+CO2↑ H2SiO3或H4SiO4 向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤 3.5×10-2mol/L
2NaGaO2+CO2↑ H2SiO3或H4SiO4 向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤 3.5×10-2mol/L ![]() 抑制
抑制![]() 水解,并阻止H+在阴极放电降低电解效率
水解,并阻止H+在阴极放电降低电解效率
【解析】
混合焙烧时,Al2O3、Ga2O3、SiO2与Na2CO3反应,生成可溶性盐NaAlO2、NaGaO2、Na2SiO3,CaO、MgO、Fe2O3不发生反应;将固体溶解,MgO、Fe2O3不溶于水,CaO溶于水生成Ca(OH)2,溶液中溶质为Ca(OH)2、NaAlO2、NaGaO2、Na2SiO3、Na2CO3;加入盐酸后,溶液中溶质为FeCl3、MgCl2、CaCl2、AlCl3、GaCl3、NaCl,生成的硅酸不溶,滤渣为H2SiO3或H4SiO4,然后将滤液进行树脂吸附,得到含铝混合液和洗脱液,然后将洗脱液中的Fe3+除去,最终通过电解![]() 制备Ga。
制备Ga。
(1)将粉煤灰与纯碱粉末充分混合,可以增大反应物接触面积,加快化学反应速率;SiO2与Na2CO3固体在加热条件下能够生成Na2SiO3、CO2,因此Ga2O3在此过程中发生反应的化学方程式为:Ga2O3+Na2CO3![]() 2NaGaO2+CO2↑;
2NaGaO2+CO2↑;
(2)由上述分析可知,滤渣为:H2SiO3或H4SiO4;Al(OH)3为两性氢氧化物,能溶于强碱溶液,而Fe(OH)3、Mg(OH)2不溶于强碱溶液,因此可将Al元素转化为偏铝酸盐,然后通入CO2制取纯净的Al(OH)3,实验方案为:向混合液中加入过量NaOH,过滤,向滤液中通入足量CO2,再过滤;
(3)当c(Fe3+)恰好为l×l0-5mol·L-l时,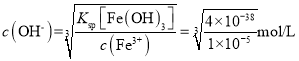 ,若此时Ga3+恰好开始沉淀,则
,若此时Ga3+恰好开始沉淀,则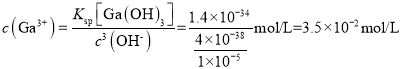 ;
;
(4)电解过程中,![]() 中Ga元素从+3价降低至0价,发生还原反应生成Ga,阳极为水失去电子生成氧气,电解总反应为:
中Ga元素从+3价降低至0价,发生还原反应生成Ga,阳极为水失去电子生成氧气,电解总反应为:![]() ;
;![]() 属于弱酸阴离子,能够发生水解生成Ga(OH)3,会降低产率,若溶液酸度过高,则溶液中H+可能会发生还原反应生成H2,会降低阴极电解效率。
属于弱酸阴离子,能够发生水解生成Ga(OH)3,会降低产率,若溶液酸度过高,则溶液中H+可能会发生还原反应生成H2,会降低阴极电解效率。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。根据该结构写出H2O2分子的电子式______。估计它难溶于CS2,简要说明原因:________________。
(2)O、S、Se原子的第一电离能由大到小的顺序为____________________。
(3)H2Se的酸性比H2S_____(填“强”或“弱”)。气态SeO3分子的立体构型为______,SeO32-离子中Se的杂化方式为______。
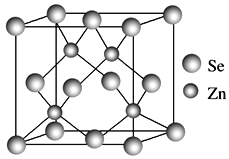
(4)硒化锌的晶胞结构如图所示,硒离子的配位数是____,若晶胞参数为d pm,则硒化锌的密度为______ g·cm-3。(不需要化简,1 m=109 nm=1012 pm)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应,2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线____(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线,
(2)若降低温度,则v(正)____,v(逆)____.(填“加快"或“减慢"或“不变”)
(3)在0到3min中内X的反应速率为____
(4)达到反应限度时X的转化率为____,注:物质的转化率= ![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,m、n、p是由这些元素组成的二元化合物,r是一种气态单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0. 0lmol/L的s溶液pH为12,X的质子数是W与Z的质子数之和的一半。下列说法正确的是
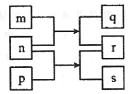
A.原子半径:W<X<Y
B.简单氢化物沸点:Z<X<Y
C.n、s中均含有离子键和共价键
D.q溶于水时温度升高,证明其水解过程放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电子式:
NaCl____________;HCl_____________
(2)第三周期元素中的最高价氧化物对应的水化物中,酸性最强的是________,碱性最强的是_____________,呈两性的氢氧化物是_______________。半径最大的原子是__________,氢化物最稳定的元素是___________。
(3)硫元素位于元素周期表中______周期_______族,气态氢化物的化学式是____________,最高价氧化物对应水化物的化学式_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:

回答下列问题:
(1)B的名称为____;D中含有的无氧官能团结构简式为____。
(2)反应④的反应类型为____;反应⑥生成G和X两种有机物,其中X的结构简为_____。
(3)反应⑤的化学反应方程式为_____(C6H7BrS用结构简式表示)。
(4)满足下列条件的C的同分异构体共有 ___种,写出其中一种有机物的结构简式:____。
①苯环上连有碳碳三键;②核磁共振氢谱共有三组波峰。
(5)请设计由苯甲醇制备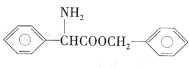 的合成路线(无机试剂任选)____:
的合成路线(无机试剂任选)____:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺肿大,因此补充人体所需的元素时也要适可而止。试回答下列问题:
(1)Fe也是人体需要补充的元素之一,试写出Fe2+的核外电子排布式:________。
(2)与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能的大小关系是________。
(3)氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上不能用电解熔融氯化铝的方法获取铝单质,这是因为________________________________________。
(4)F与I是同一主族的元素,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(5)I2晶体的晶胞结构如图所示,该晶胞中含有________个I2分子,设该晶胞的晶胞参数为acm,则I2的密度是________________g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com