
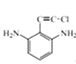
【题目】化合物G是一种药物合成中间体,其合成路线如下:

回答下列问题:
(1)B的名称为____;D中含有的无氧官能团结构简式为____。
(2)反应④的反应类型为____;反应⑥生成G和X两种有机物,其中X的结构简为_____。
(3)反应⑤的化学反应方程式为_____(C6H7BrS用结构简式表示)。
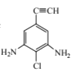
(4)满足下列条件的C的同分异构体共有 ___种,写出其中一种有机物的结构简式:____。
①苯环上连有碳碳三键;②核磁共振氢谱共有三组波峰。
(5)请设计由苯甲醇制备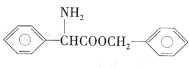 的合成路线(无机试剂任选)____:
的合成路线(无机试剂任选)____:
【答案】邻氯苯甲醛或2-氯苯甲醛 -NH2和-Cl 取代反应或酯化反应 HOCH2CH2OH 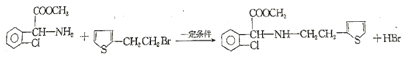 4
4 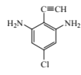 、
、 、
、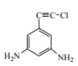 、
、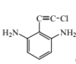 (任写一种即可)
(任写一种即可) 
【解析】
对比D与F的结构可知,D与甲醇发生酯化反应生成E,E与C6H7BrS发生取代反应生成F,则E的结构简式为: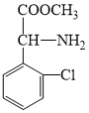 ;C6H7BrS的结构简式为:
;C6H7BrS的结构简式为:![]() ;
;
(5)由苯甲醇制备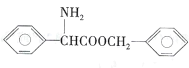 ,
,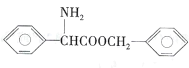 可由
可由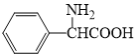 与苯甲醇发生酯化反应生成,若要利用苯甲醇合成
与苯甲醇发生酯化反应生成,若要利用苯甲醇合成 ,则需要增长碳链、引进氨基、羧基,结合题干中物质转化关系解答。
,则需要增长碳链、引进氨基、羧基,结合题干中物质转化关系解答。
(1)以苯甲醛为母体,氯原子为取代基,因此其名称为:邻氯苯甲醛或2-氯苯甲醛;D中含有的官能团为:氨基、羧基、氯原子,其中无氧官能团为:-NH2和-Cl;
(2)由上述分析可知,该反应为酯化反应或取代反应;对比该反应中各物质的结构简式可知,![]() 该碳原子与N原子和C原子成环,
该碳原子与N原子和C原子成环,![]() 中的断键方式为
中的断键方式为![]() ,因此X的结构简式为:HOCH2CH2OH;
,因此X的结构简式为:HOCH2CH2OH;
(3)反应⑤为 与
与![]() 发生取代反应生成
发生取代反应生成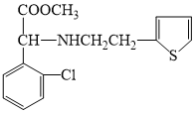 ,其化学方程式为:
,其化学方程式为: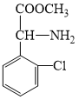 +
+![]()
![]()
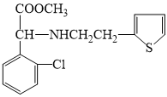 +HBr;
+HBr;
(4
②核磁共振氢谱共有三组波峰,则说明一共含有3种化学环境的氢原子,则该结构一定存在对称结构;
则该同分异构体的母体为![]() ,将氨基、氯原子分别补充到结构式中,并满足存在对称结构,结构简式为:
,将氨基、氯原子分别补充到结构式中,并满足存在对称结构,结构简式为: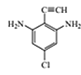 、
、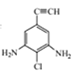 、
、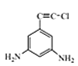 、
、 ;
;
(5)由上述分析可知,合成中需要增长碳链、引进氨基、羧基,引进氨基、增长碳链可以利用题干中②反应的条件,引进羧基可利用题干中③反应的条件,因此具体合成路线为: 。
。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】根据电子排布三原理,填写下列空白。
(1)基态Mn2+的核外电子排布式为________。
(2)磷原子外围电子排布式为________。
(3)氧元素基态原子核外未成对电子数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①——⑨在表中的位置,回答问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧是用于半导体材料的元素,其元素符号为____,其在周期表中的位置是____。
(2)②、③、④的原子半径最小是____(填元素符号),其原子结构示意图是____。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是____(填化学式)。
(4)①和③形成的原子个数比为1:1的化合物的电子式为____。
(5)⑤和⑨形成的化合物属于____(填“离子化合物”或“共价化合物”),用电子式表示其形成过程____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
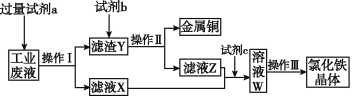
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中主要含有Al2O3,除此之外还含有Ga2O3及少量Fe2O3、CaO、MgO和SiO2等物质。已知从粉煤灰中回收铝并提取镓的工艺流程如下所示:
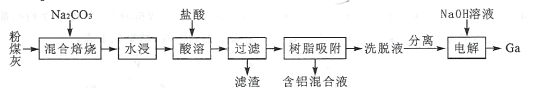
回答下列问题:
(1)焙烧前,应将粉煤灰与纯碱粉末充分混合,其原因是____;混合焙烧时,Al2O3、Ga2O3均发生类似于SiO2的反应,试写出Ga2O3在此过程中发生反应的化学方程式:____。
(2)滤渣的成分是____ ;含铝混合液中除了大量A13+之外,还有Fe3+和少量Mg2+,由混合液制取纯净Al(OH)3的实验方案是_____。
(3)洗脱液中往往还有少量Fe3+,需要进一步分离。若使Fe3+恰好完全沉淀[c(Fe3+)= l×l0-5mol·L-l]时,Ga3+浓度至少为_____mol·L-l才会开始沉淀。(已知:![]() 。)
。)
(4)电解过程中,Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电,则电解方程式为____;电解过程中需要保持溶液为pH=11以上的原因是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列物质的用途,叙述不正确的是( )
A.氨容易液化,常用作制冷剂
B.浓硫酸可作干燥剂,但不可干燥![]() ,因为浓硫酸具有强氧化性,
,因为浓硫酸具有强氧化性,![]() 具有还原性
具有还原性
C.硅胶可用于袋装食品或药品的干燥剂,也可用作催化剂的载体
D.![]() 均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
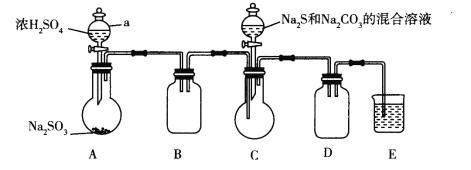
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
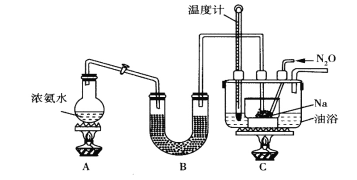
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
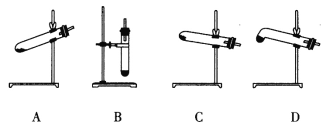
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
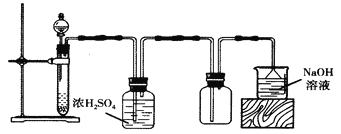
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com