
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
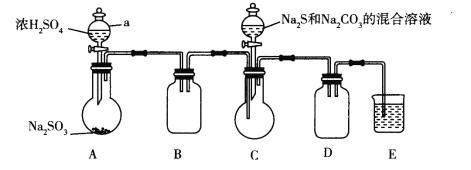
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
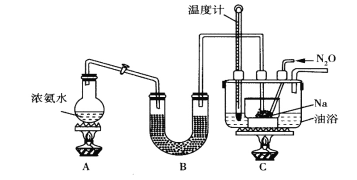
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
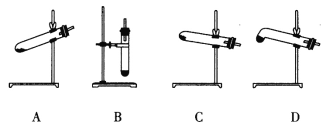
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
【答案】检查装置气密性 分液漏斗 B 吸收多余的SO2和C装置中生成的CO2气体 蒸发浓缩,冷却结晶 玻璃棒、烧杯、漏斗 碱石灰 制备NaN3的反应需要在210-220oC下进行,水浴不能达到这样的温度 2Na+2NH3=2NaNH2+H2 D
【解析】
I.(1)组装好仪器后,接下来应该进行的实验操作是检查装置气密性,然后加入试剂。仪器a的名称是分液漏斗。二氧化硫有毒,需要尾气处理,且反应中还有二氧化碳生成,澄清石灰水浓度太低,则E中的试剂最好是氢氧化钠溶液,作用是吸收多余的SO2和C装置中生成的CO2气体。
(2)由于五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经蒸发浓缩,冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有玻璃棒、烧杯、漏斗。
Ⅱ.(1)生成的氨气中含有水蒸气,需要干燥,则装置B中盛放的药品为碱石灰。
(2)由于制备NaN3的反应需要在210~220oC下进行,水浴不能达到这样的温度,所以实验中使用油浴而不用水浴。
(3)氨气与熔融的钠反应生成NaNH2,根据原子守恒可知还有氢气生成,反应的化学方程式为2Na+2NH3=2NaNH2+H2。
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,由于在该温度下硝酸铵已熔化,同时为避免液体倒流引起试管炸裂,因此选择的气体发生装置是装置D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上常用NOx+NH3![]() N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3B.2∶1
C.3∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,m、n、p是由这些元素组成的二元化合物,r是一种气态单质,n为淡黄色粉末,相关物质转化关系如图所示。室温下,0. 0lmol/L的s溶液pH为12,X的质子数是W与Z的质子数之和的一半。下列说法正确的是
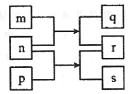
A.原子半径:W<X<Y
B.简单氢化物沸点:Z<X<Y
C.n、s中均含有离子键和共价键
D.q溶于水时温度升高,证明其水解过程放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:

回答下列问题:
(1)B的名称为____;D中含有的无氧官能团结构简式为____。
(2)反应④的反应类型为____;反应⑥生成G和X两种有机物,其中X的结构简为_____。
(3)反应⑤的化学反应方程式为_____(C6H7BrS用结构简式表示)。
(4)满足下列条件的C的同分异构体共有 ___种,写出其中一种有机物的结构简式:____。
①苯环上连有碳碳三键;②核磁共振氢谱共有三组波峰。
(5)请设计由苯甲醇制备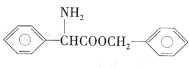 的合成路线(无机试剂任选)____:
的合成路线(无机试剂任选)____:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是( )

A.该有机物的分子式为:C18H30N3O8P2Cl
B.该有机物能够发生加成反应、取代反应、不能发生氧化反应
C.该有机物苯环上的1-溴代物只有2种
D.1mol该有机物最多能和8molNaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
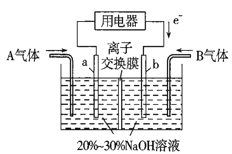
①b极的电极反应式为______________________。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为________。
NaNO2(aq)+H2O(1)的平衡常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列有关实验的叙述,错误的是(填序号)_______;
A 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B 分馏石油时,温度计的末端必须插入液面下
C 用分液漏斗分离环己烷和水的混合液体
D 用浓氨水洗涤做过银镜反应的试管
E 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
(2)人造羊毛在许多方面比天然羊毛更优良,其分子存在如下结构:
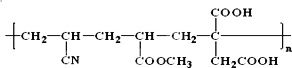
合成它的单体有_________。
(3)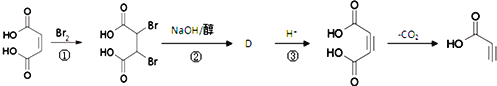
写出反应②的化学方程式 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,能表示反应 2X(g)+2Y(s)![]() Z(g) 一定达到化学平衡状态的是
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A. ①②③⑥ B. ①③④⑤ C. ②③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com