
【题目】工业上常用NOx+NH3![]() N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3B.2∶1
C.3∶1D.1∶1
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,总反应:
2Cu+H2O![]() Cu2O+H2
Cu2O+H2![]() 。下列说法正确的是
。下列说法正确的是

A. 石墨电极发生氧化反应
B. 铜电极发生的电极反应式:2Cu-2e- + H2O==Cu2O+2H+
C. 电解后溶液的PH减小
D. 当有0.1mol电子转移时,有0.05 molCu2O生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电离率。饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%
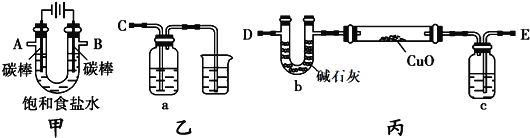
甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为_____; 该电解池总反应的化学方程式为_______;
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为________连______(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为_______;
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则 该干燥装置应与______口连接(填A、B、C、D、E等导管口)。
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?_____(填“同意”或“不同意”)请说明理由 ____。
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率_______(保留一位小数,假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电子排布三原理,填写下列空白。
(1)基态Mn2+的核外电子排布式为________。
(2)磷原子外围电子排布式为________。
(3)氧元素基态原子核外未成对电子数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校购买的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为1.84mol/L
B. 1mol Zn与足量的该硫酸反应产生2gH2
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废水含Na+、K+、Mg2+、Cl-和SO42-等离子。利用微生物电池进行废水脱盐的同时处理含OCN-的酸性废水,装置如图所示。下列说法错误的是
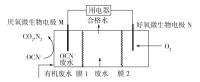
A.好氧微生物电极N为正极
B.膜1、膜2依次为阴离子、阳离子交换膜
C.通过膜1和膜2的阴离子总数一定等于阳离子总数
D.电极M的电极反应式为2OCN-6e+2H2O=2CO2↑+N2↑+4H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年爆发的新冠肺炎让漂白粉及漂白液的销量大增。请回答下面的问题:
(1)工业上常将氯气制成漂白粉,而不是制成次氯酸的原因是______________________,制漂白粉的化学方程式是________
(2)下列物质露置在空气中会变质,在变化过程中既有非氧化还原反应发生,又有氧化还原反应发生的是________。
A.生石灰 B.漂白粉C.NaOH D.Na2SO3
(3)写出下列两个化学方程式。
①漂白粉+稀盐酸:__________
②漂白粉+浓盐酸:_______________________
(4)用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是_____(填序号)。
①HCl ②O2 ③CO2 ④H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①——⑨在表中的位置,回答问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧是用于半导体材料的元素,其元素符号为____,其在周期表中的位置是____。
(2)②、③、④的原子半径最小是____(填元素符号),其原子结构示意图是____。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是____(填化学式)。
(4)①和③形成的原子个数比为1:1的化合物的电子式为____。
(5)⑤和⑨形成的化合物属于____(填“离子化合物”或“共价化合物”),用电子式表示其形成过程____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
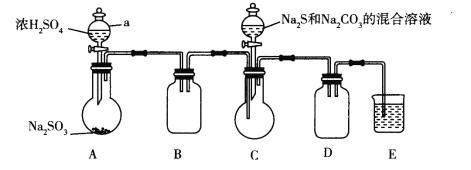
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
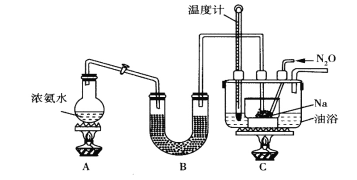
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com