
【题目】某废水含Na+、K+、Mg2+、Cl-和SO42-等离子。利用微生物电池进行废水脱盐的同时处理含OCN-的酸性废水,装置如图所示。下列说法错误的是
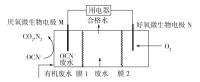
A.好氧微生物电极N为正极
B.膜1、膜2依次为阴离子、阳离子交换膜
C.通过膜1和膜2的阴离子总数一定等于阳离子总数
D.电极M的电极反应式为2OCN-6e+2H2O=2CO2↑+N2↑+4H
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】金属铝在生产生活中有着广泛的用途。回答下列问题:
(1)铝元素在周期表中的位置是_______________。
(2)比较原子结构示意图:它们的共同之处是___________![]() 选填编号,下同
选填编号,下同![]() ;不同之处是___________。
;不同之处是___________。
a.电子层数b.次外层电子数c.最外层电子数d.质子数
(3)常温下铝制容器可以用来盛放浓硫酸而不被溶解,这种现象称为___________。
氢氧化铝和盐酸反应的化学方程式为_________________________________。
能把溶液中的铁离子和铝离子分离开的试剂是___________。![]() 选填编号
选填编号![]()
a.盐酸b.硫酸铜溶液 c.氨水 d.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是______;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
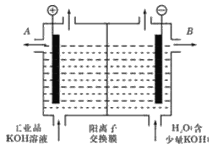
①该电解槽的阳极反应式是________;
②除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
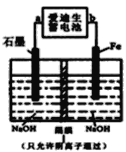
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是______。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE( )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为 ___(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用NOx+NH3![]() N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3B.2∶1
C.3∶1D.1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a g,12C核素的质量为b g,NA是阿伏加德罗常数,下列说法中错误的是( )
Hf是我国科学家首次合成的一种过渡金属的新核素,该核素在高科技领域有着重要的用途。若一个该核素的质量为a g,12C核素的质量为b g,NA是阿伏加德罗常数,下列说法中错误的是( )
A. NA=![]()
B. WgHf的物质的量为![]() mol
mol
C. ![]() Hf的摩尔质量为
Hf的摩尔质量为![]() g/mol
g/mol
D. 等物质的量的![]() Hf、12C质量比为b∶a
Hf、12C质量比为b∶a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
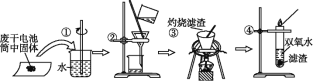
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组同学想用金属钠和空气制备纯度较高的Na2O2(N2不与金属钠应),可利用的装置如下。回答下列问题:
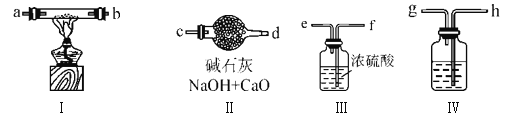
(1)装置Ⅳ中盛放的药品是________,若没有该装置可能导致生成的Na2O2中含有碳酸钠,其反应方程式为____________________________。
(2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:
空气进入h,________接________,________接________,________接________,d
(3)装置Ⅱ的作用是_____________________________________________________。
(4)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为________________,红色褪去的可能原因是____________________。
② 加入MnO2反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
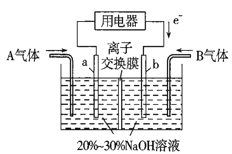
①b极的电极反应式为______________________。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为________。
NaNO2(aq)+H2O(1)的平衡常数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com