
【题目】近年来,我国对雾霾的治理重视有加。研究NO2、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是__________________。
(2)在恒温恒容的容器中充入3molCO,3molH2发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
CH3OCH3(g)+H2O(g),下列说法可以判断反应一定达到平衡状态的是____________。
A.CO和CH3OCH3(g)的生成速率相等
B.混合物中CO的体积分数保持不变
C.反应容器中的压强不再变化
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存
E.反应容器中混合气体的平均摩尔质量保持不变
(3)利用反应6NO2+8NH3=7N2+12H2O设计为电池可消除NO2,其简易装置如图所示。
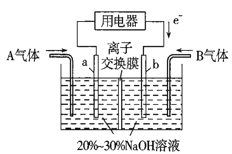
①b极的电极反应式为______________________。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,则理论上a极上消耗A气体的体积为_____mL(气体处于标准状况;假设电解过程中溶液体积不变)。
(4)化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
已知:①2NO(g)=N2(g)+O2(g) H1= -177kJ.mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g) H2= -1253.4kJ.mol-1
则用NH3处理NO生成氮气和气态水的热化学方程式为___________________。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,则该反应的化学方程式为____________。已知常温下.Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为________。
NaNO2(aq)+H2O(1)的平衡常数为________。
【答案】2OH-+SO2=SO32-+H2O BCE 2NO2+8e-+4H2O=N2+8OH- 448 4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H=-1784.4kJ·mol-1 NO+NO2+2NaOH=2NaNO2+H2O 5×1010
【解析】
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,发生反应的离子方程式是2OH-+SO2=SO32-+H2O。
(2)A.CO和CH3OCH3(g)的生成速率相等不满足正逆反应速率相等,没有达到平衡状态,A错误;
B.混合物中CO的体积分数保持不变说明正逆反应速率相等,达到了平衡状态,B正确;
C.正反应体积减小,反应容器中的压强不再变化说明正逆反应速率相等,达到了平衡状态,C正确;
D.反应容器内CO、H2、CH3OCH3(g)、H2O(g)四者共存不能说明正逆反应速率相等,不一定达到平衡状态,D错误;
E.气体质量不变,物质的量减小,则反应容器中混合气体的平均摩尔质量保持不变说明正逆反应速率相等,达到了平衡状态,E正确;
答案选BCE。
(3)①b极电子流入,是正极,NO2得到电子,电极反应式为2NO2+8e-+4H2O=N2+8OH-。
②常温下,若用该电池电解0.6L饱和KCl溶液,一段时间后,测得饱和KCl溶液pH变为13,生成氢氧化钾是0.6L×0.1mol/L=0.06mol,转移0.06mol电子,a电极氨气放电,1mol氨气转移3mol电子,则理论上a极上消耗A气体的物质的量是0.02mol,体积为448mL。
(4)已知:①2NO(g)=N2(g)+O2(g)H1= -177kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)H2= -1253.4kJ·mol-1
则根据盖斯定律可知①×3+②即得到NH3处理NO生成氮气和气态水的热化学方程式为4NH3(g)+6NO(g)=5N2(g)+6H2O(g) H=-1784.4kJ·mol-1。
(5)氨氧化物可用碱溶液吸收。若NO和NO2混合气体被NaOH溶液完全吸收,只生成一种盐,该盐是亚硝酸钠,则该反应的化学方程式为NO+NO2+2NaOH=2NaNO2+H2O。已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(1)的平衡常数为
NaNO2(aq)+H2O(1)的平衡常数为![]() =5×1010。
=5×1010。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某废水含Na+、K+、Mg2+、Cl-和SO42-等离子。利用微生物电池进行废水脱盐的同时处理含OCN-的酸性废水,装置如图所示。下列说法错误的是
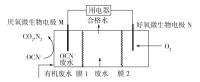
A.好氧微生物电极N为正极
B.膜1、膜2依次为阴离子、阳离子交换膜
C.通过膜1和膜2的阴离子总数一定等于阳离子总数
D.电极M的电极反应式为2OCN-6e+2H2O=2CO2↑+N2↑+4H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
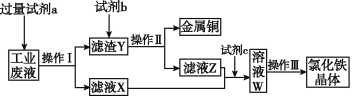
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列物质的用途,叙述不正确的是( )
A.氨容易液化,常用作制冷剂
B.浓硫酸可作干燥剂,但不可干燥![]() ,因为浓硫酸具有强氧化性,
,因为浓硫酸具有强氧化性,![]() 具有还原性
具有还原性
C.硅胶可用于袋装食品或药品的干燥剂,也可用作催化剂的载体
D.![]() 均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
均可用于自来水的杀菌、消毒剂,而明矾可作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
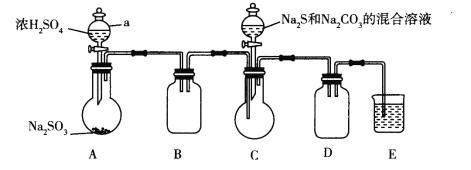
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
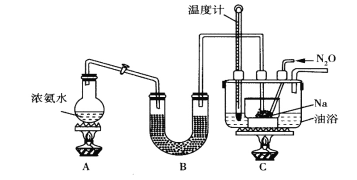
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
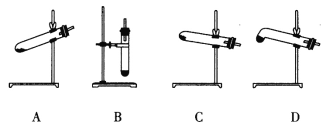
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如下,下列有关R的说法正确的是( )
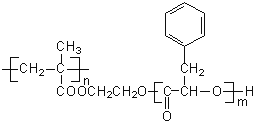
A. R的单体之一的分子式为C9H10O2
B. R完全水解后生成物均为小分子有机物
C. 通过加聚反应和缩聚反应可以生成R
D. 碱性条件下,1molR完全水解消耗NaOH的物质的量为2nmol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
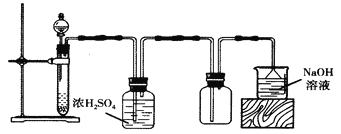
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(气)+B(气) ![]() xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)反应达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=___________。
(2)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是__ (填写字母序号)。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(3)在T℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入__________(填A或B)________mol(用a表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com