
【题目】(1)下列有关实验的叙述,错误的是(填序号)_______;
A 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B 分馏石油时,温度计的末端必须插入液面下
C 用分液漏斗分离环己烷和水的混合液体
D 用浓氨水洗涤做过银镜反应的试管
E 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
(2)人造羊毛在许多方面比天然羊毛更优良,其分子存在如下结构:
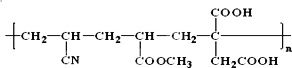
合成它的单体有_________。
(3)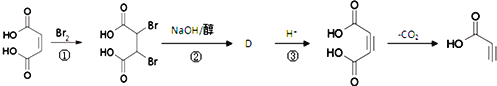
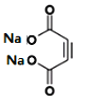
写出反应②的化学方程式 __________。
【答案】ABD CH2=CH﹣CN;CH2=CH﹣COOCH3;CH2=C(COOH)﹣CH2COOH 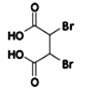 +4NaOH
+4NaOH
 +2NaBr+4H2O
+2NaBr+4H2O
【解析】
根据物质的性质对有关实验的叙述进行分析;根据高聚物的结构特点分析单体结构;根据有机物的结构变化及反应条件分析发生的化学反应写出相应方程式。
(1)A.NaOH溶液能使乙酸乙酯水解,故A错误;
B.分馏石油时,温度计的末端应靠近蒸馏烧瓶的支管口处,故B错误;
C.环己烷和水不互溶且密度比水的密度要小,可以用分液漏斗分离环己烷和水的混合液体,故C正确;
D.银单质与氨水不反应,可用稀硝酸洗去,故D错误;
E.向硝酸银溶液中滴加氨水,等到白色沉淀恰好溶解时,可以获得银氨溶液,故E正确;
故选ABD。
(2)链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,结构简式中主链上有6个碳原子其单体必为3种,将双键中的3个C—C打开,然后将半键闭合即可得该高聚物单体是 CH2=CH﹣CN;CH2=CH﹣COOCH3;CH2=C(COOH)﹣CH2COOH;
(3)根据反应前后的结构变化及反应条件分析,反应②为消去反应,形成碳碳三键,同时结构中还含有羧基,与氢氧化钠发生中和反应,所以反应②的化学方程式为: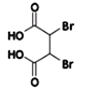 +4NaOH
+4NaOH
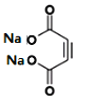 +2NaBr+4H2O。
+2NaBr+4H2O。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①——⑨在表中的位置,回答问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧是用于半导体材料的元素,其元素符号为____,其在周期表中的位置是____。
(2)②、③、④的原子半径最小是____(填元素符号),其原子结构示意图是____。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是____(填化学式)。
(4)①和③形成的原子个数比为1:1的化合物的电子式为____。
(5)⑤和⑨形成的化合物属于____(填“离子化合物”或“共价化合物”),用电子式表示其形成过程____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学的发展,可逐步合成很多重要的化工产品,如用作照相定影剂的硫代硫酸钠(俗称大苏打),用于填充汽车安全气囊的叠氮化钠(NaN3),某化学兴趣小组拟制备硫代硫酸钠晶体和NaN3。
I.制备硫代硫酸钠晶体。
查阅资料:Na2S2O3易溶于水,向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。实验装置如图所示(省略夹持装置):
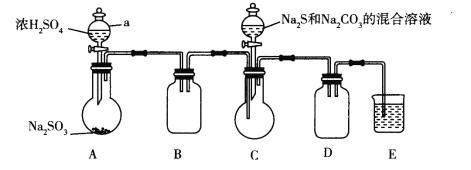
(1)组装好仪器后,接下来应该进行的实验操作是_____,然后加入试剂。仪器a的名称是_______;E中的试剂最好是__________.(填标号),作用是______________。
A.澄清石灰水B.NaOH溶液 C.饱和NaHSO3溶液
(2)已知五水合硫代硫酸钠的溶解度随温度升高显著增大。待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经_________(填操作名称)、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有______________。
Ⅱ.实验室利用如图装置(省略夹持装置)模拟工业级NaN3的制备。已知:2NaNH2+N2O![]() NaN3+NaOH+NH3。
NaN3+NaOH+NH3。
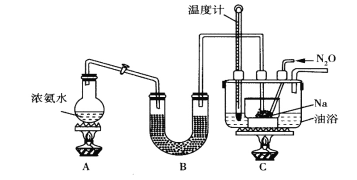
(1)装置B中盛放的药品为__________
(2)实验中使用油浴而不用水浴的原因是__________________________。
(3)氨气与熔融的钠反应生成NaNH2的化学方程式为_________________。
(4)N2O可由NH4NO3(熔点为169.6oC)在240oC下分解制得,应选择的气体发生装置是___________。
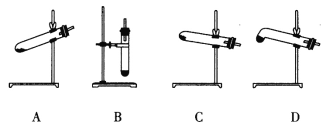
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
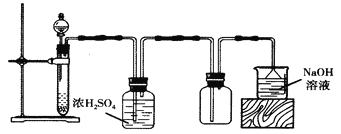
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
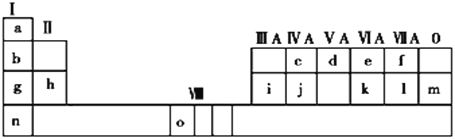
试回答下列问题:
(1)请写出元素o的基态原子电子排布式_______。
(2)d的氢化物的分子构型为_____;k在空气中燃烧产物的中心原子的杂化形式为____,该分子是______(填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是_____(填具体物质),试从结构角度加以解释______
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
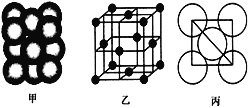
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为______。
②该晶体的密度为______ (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
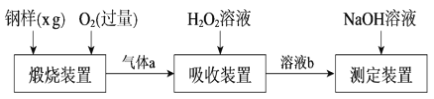
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是
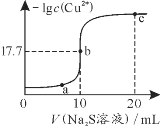
A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
B.a、b、c三点对应的溶液中,水的电离程度最小的为b点
C.c点溶液中c(Cu2+)=10-34.4 mol·L-1
D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com