
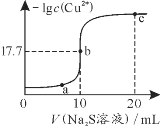
【题目】某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是
A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
B.a、b、c三点对应的溶液中,水的电离程度最小的为b点
C.c点溶液中c(Cu2+)=10-34.4 mol·L-1
D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,Cu2+单独存在或S2-单独存在均会发生水解,水解促进水的电离,结合溶度积常数和溶液中的守恒思想分析解答。
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,Cu2+单独存在或S2-单独存在均会发生水解,水解促进水的电离,b点滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)Cu2+(aq)+S2-(aq),已知此时-lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2-)=10-17.7mol/L。
A.Na2S溶液显碱性,根据质子守恒,c(H+)+c(HS-)+2c(H2S)=c(OH-),故A错误;
B.a、c两点Cu2+、S2-的水解促进了水的电离,水的电离程度增大,b点可认为是NaCl溶液,水的电离没有被促进和抑制,水的电离程度最小,故B正确;
C.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)c(S2-) =10-17.7mol/L×10-17.7mol/L =10-35.4mol2/L2,c点溶液中含有NaCl和Na2S,c(S2-)=![]() ×0.1mol/L,因此 c(Cu2+)=
×0.1mol/L,因此 c(Cu2+)=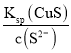 =
=![]() =3×10-34.4 mol/L,故C错误;
=3×10-34.4 mol/L,故C错误;
D.向100 mLZn2+、Cu2+浓度均为0.1molL-1的混合溶液中逐滴加入10-3 molL-1的Na2S溶液,产生ZnS时需要的S2-浓度为c(S2-)=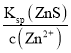 =
=![]() mol/L=3×10-24mol/L;产生CuS时需要的S2-浓度为c(S2-)=
mol/L=3×10-24mol/L;产生CuS时需要的S2-浓度为c(S2-)=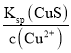 =
=![]() mol/L=10-34.4mol/L,则产生CuS沉淀所需S2-浓度更小,先产生CuS沉淀,故D错误;
mol/L=10-34.4mol/L,则产生CuS沉淀所需S2-浓度更小,先产生CuS沉淀,故D错误;
故选B。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】(1)下列有关实验的叙述,错误的是(填序号)_______;
A 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B 分馏石油时,温度计的末端必须插入液面下
C 用分液漏斗分离环己烷和水的混合液体
D 用浓氨水洗涤做过银镜反应的试管
E 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止
(2)人造羊毛在许多方面比天然羊毛更优良,其分子存在如下结构:
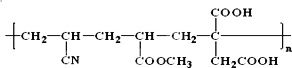
合成它的单体有_________。
(3)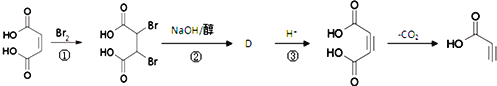
写出反应②的化学方程式 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容时,能表示反应 2X(g)+2Y(s)![]() Z(g) 一定达到化学平衡状态的是
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A. ①②③⑥ B. ①③④⑤ C. ②③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4L(标准状况)H2,下列说法错误的是( )
A. 该醇是乙二醇B. 该羧酸有3种同分异构体
C. 该羧酸含有的官能团是羟基和羧基D. 该羧酸的分子式是C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是
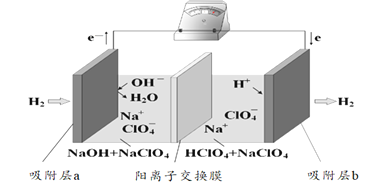
A.“全氢电池”工作时,将酸碱反应的中和能转化为电能
B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O
C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动
D.“全氢电池”的总反应: 2H2 + O2 =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式:__。
②铅蓄电池放电时,溶液的pH将_(填增大、减小或不变);当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为__。
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___;若将负极材料改为CH4,写出其负极反应方程式__。

(3)法国格勒诺布尔(Grenoble)约瑟夫﹒傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶(蛋白质)的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法正确的是__。
6CO2+6H2O(酸性环境)。下列有关该电池的说法正确的是__。
A.该生物燃料电池不能在高温下工作
B.该电池负极的电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.消耗1mol氧气时转移4mol电子,H+向负极移动
D.提高葡萄糖生物燃料电池的效率,可使其在将来为更多可植入医疗设备提供电能
(4)1958年世界上第一个心脏起搏器在瑞典植入人体成功,使用寿命长达10年之久。这种能源起搏器中安装寿命最长、可靠性最高的锂—碳电池,这种电池容量大,电压稳定,能在-56.7~71.1℃温度范围内正常工作。现已在火箭、移动电话、笔记本电脑中广泛使用。它采用锂和石墨作电极,四氯化铝锂(LiAlCl4)溶解在亚硫酰氯中(SOCl2)组成电解质溶液。电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S,此电池中___作正极,负极的电极反应为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
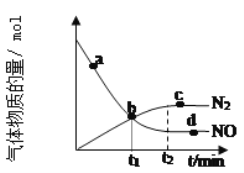
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
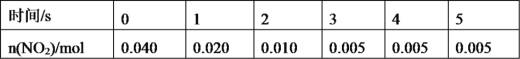
①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
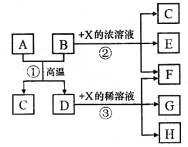
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
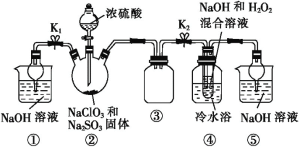
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。利用如图所示装置进行实验。
(1)装置①的作用是________,装置④中反应生成NaClO2的离子方程式为______ 。
(2)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①_______,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④___________________,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4 : _______________________。
(4)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,达到注定终点时的现象为:_____________________________________________。重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL,则NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com