
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
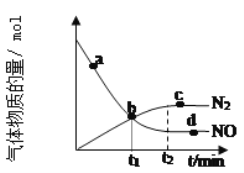
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
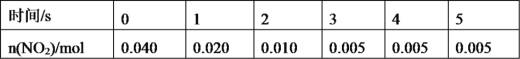
①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
【答案】bc > = 0.00375mol·L-1·s-1(或0.225mol·L-1·min-1) 87.5% 随着反应的进行,反应物NO2的物质的量浓度减小,因而反应速率减小
【解析】
(1)①a.该反应达到平衡状态时,5v正(NH3)=4v逆(N2),故a错误;
b.该反应是一个反应前后气体体积增大的可逆反应,容器体积恒定,所以未平衡时压强会发生改变,当压强不再变化时说明反应平衡,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不在改变,反应达到平衡,故c正确;
d.物质的量之比不能说明正逆反应速率相等或者浓度不变,故d错误;
e.只要反应进行12mol N-H 键断裂的同时就会生成5mol N≡N键,二者均表示正反应速率,故e错误;
故答案为:bc;
②据图可知b点之后氮气的浓度增大,NO的浓度减小,说明此时反应正向进行,及v(正)> v(逆);d点时NO的浓度不再变化,说明反应达到平衡,所以v(正)= v(逆);
(2)①0~2s内v(NO2)= =0.0075mol·L-1·s-1,同一反应同一时段内不同物质的反应速率之比等于计量数之比,所以v(N2O4)=0.5v(NO2)=0.00375mol·L-1·s-1;第5s时,二氧化氮的转化率为
=0.0075mol·L-1·s-1,同一反应同一时段内不同物质的反应速率之比等于计量数之比,所以v(N2O4)=0.5v(NO2)=0.00375mol·L-1·s-1;第5s时,二氧化氮的转化率为![]() =87.5%;
=87.5%;
②随着反应的进行,反应物NO2的物质的量浓度减小,因而反应速率减小。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】硫的含量影响钢铁性能。一种测定硫含量的方法是将钢样中硫转化为二氧化硫气体,再用测硫装置进行测定。某测定硫含量的流程如下:
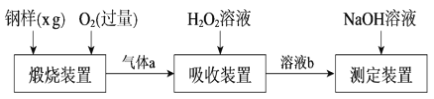
(1)气体a的主要成分有CO2、______、______。
(2)若钢样中硫以FeS的形式存在,煅烧装置中发生的化学反应为3FeS+5O2 ![]() 1______ +3______。___________
1______ +3______。___________
(3)吸收装置中,H2O2氧化SO2的化学方程式是_________________。
(4)用NaOH溶液中和生成的溶液b,消耗z mLNaOH溶液,若消耗1 mLNaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图(部分产物未列出),A是一种金属单质,D是一种非金属固体单质。
请回答下列问题:

(1)A、C的化学式分别为A_________,C_________;
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是_____;
A.C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B.Fe+H2SO4═FeSO4+H2↑
C.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D.FeO+H2SO4═FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:____________;
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是
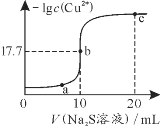
A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
B.a、b、c三点对应的溶液中,水的电离程度最小的为b点
C.c点溶液中c(Cu2+)=10-34.4 mol·L-1
D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: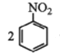 +3Sn+12HCl
+3Sn+12HCl![]()
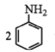 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
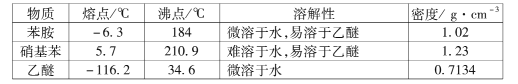
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
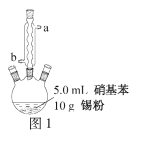
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
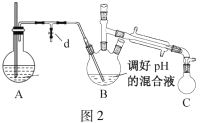
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、M、N、O、P,原子序数逐渐增大,其中X、Y、Z、M、N为短周期元素,而X、Y、Z、M处于同周期的P区,且未成对电子数之比为1:2:3:2;N与Z同族。O、P分别位于周期表第2、4列,P的单质被称为“未来金属”,具有质量轻、强度大、耐腐蚀性好的优点。
(1)Y、Z、M三种元素的电负性由大到小的顺序:________(用元素符号表示)。
(2)M的常见氢化物的氢键的键能小于HF的氢键的键能,但Z的常见氢化物常温下为液态而HF常温下为气态的原因是:__________。
(3)XN一种耐磨涂料,可用于金属表面保护层,该化合物可由X的三溴化物和N的三溴化物于高温下在氢气的氛围中合成。
①写出合成XN的化学方程式:_________。(各物质用化学式表示)
②XN的晶体的晶胞如图所示:
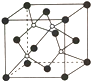
其中实心球为N,在一个晶胞中N原子空间堆积方式为______,N原子的配位数为______;该结构中有一个配位键,提供空轨道的原子是________(写元素符号)。
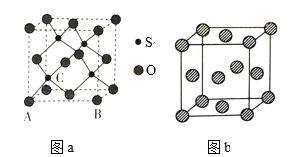
(4)O和硫形成的某种晶体的晶胞如图a所示:该晶胞原子的坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为_______。
(5)图b为P的一种面心立方晶胞结构,若晶胞的边长为anm,则P的密度为_____g·cm-3(用含a和NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL NO2气体和336 mL的N2O4气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02 gB.8.51 gC.8.26 gD.7.04 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧时产生大量SO2、NO对环境影响极大。
(1)使用清洁能源可有效减少SO2等的排放。煤的液化是现代能源工业中重点推广的能源综合利用方案,最常见的液化方法为用煤生产CH3OH。已知制备甲醇的有关化学反应及平衡常数如下:
i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+b kJ/mol
CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3
CH3OH(g) ΔH3
ΔH3=________。
(2)在密闭容器中进行反应i,改变温度时,该反应中的所有物质都为气态,起始温度、体积相同(T1 ℃、2 L密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ恒 温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ绝 热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)________K(Ⅱ)(填“>”“<”或“=”下同);平衡时CO2的浓度c(Ⅰ)________c(Ⅱ)。
②对反应Ⅰ,在其他条件不变下,若30 min时只改变温度为T2 ℃,再次平衡时H2的物质的量为2.5 mol,则T1________T2(填“>”“<”或“=”)。
③若30 min时只向容器中再充入1 mol H2(g)和1 mol H2O(g),则平衡________移动(填“正向”“逆向”或“不”)。
(3)研究人员发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO发生该反应,如图为容器内的压强(p)与起始压强(p0)的比值(p/p0)随时间的变化曲线。
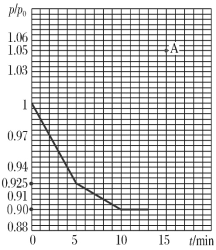
①0~5 min内,该反应的平均反应速率v(NO)=________;平衡时N2的产率为________。
②若13 min时,向该容器中再充入0.06 mol CO2,15 min时再次达到平衡,此时容器内![]() /
/![]() 的比值应在图中A点的________(填“上方”或“下方”)。
的比值应在图中A点的________(填“上方”或“下方”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com