
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
科目:高中化学 来源: 题型:
【题目】恒温恒容时,能表示反应 2X(g)+2Y(s)![]() Z(g) 一定达到化学平衡状态的是
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A. ①②③⑥ B. ①③④⑤ C. ②③⑤⑥ D. ②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___。
a.反应速率v(NH3)=v(N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O)=6∶4∶5∶6
e.12mol N-H键断裂的同时生成5mol N≡N键
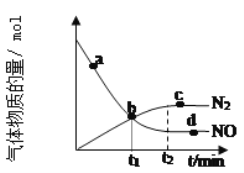
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正)___v(逆);d点对应的速率关系是v(正)___v(逆)。(填﹥、﹤或﹦)。
(2)一定条件下,在2L密闭容器内,反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
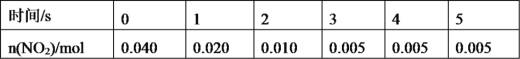
①用N2O4表示0~2s内该反应的平均速率为___。在第5s时,NO2的转化率为___。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示几种无机物之间的转换关系。其中A为磁性黑色晶体,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体。
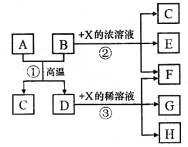
请回答下列问题:
(1)A的化学式为____________,C的电子式为_______________。
(2)反应②的化学方程式为___________________________。
(3)A与盐酸反应的离子方程式为________________________。
(4)反应③在X溶液温度、浓度不同时,产物也不同,则过量的D分别与一定量不同温度、浓度的X稀溶液反应时,若4mol X参加反应转移了3mol电子,此时反应的离子方程式为____________________;若5mol X参加反应转移了4mol电子,此时X的还原产物可能是下列选项中的______________。
a.NO b.N2O c.N2 d.NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升。
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)NH3的电子式______。
(2)氯化铵水溶液显酸性,其原因为______(用离子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固体,溶液的pH______(填“升高”或“降低”);若加入少量的明矾固体后,请尝试从平衡移动的角度解释溶液中NH4+浓度的变化原因______。
(3)硝酸铵加热分解可得到N2O(g)和H2O(g),250℃时,硝酸铵在密闭容器中分解达到平衡,该温度下反应的平衡常数表达式为______;若有1mol硝酸铵完全分解,转移的电子数为______mol。
(4)3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,若反应放出9.2kJ 热量,则参加反应的氢气分子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
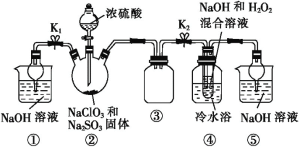
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。利用如图所示装置进行实验。
(1)装置①的作用是________,装置④中反应生成NaClO2的离子方程式为______ 。
(2)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①_______,55 ℃蒸发结晶;②趁热过滤;③用38~60 ℃的温水洗涤;④___________________,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4 : _______________________。
(4)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,达到注定终点时的现象为:_____________________________________________。重复3次,消耗Na2S2O3溶液的体积依次为:19.50 mL、20.50 mL、22.00 mL,则NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】罗氟司特是治疗慢性阻塞性肺病的特效药物,其合成中间体F的一种合成路线如下:
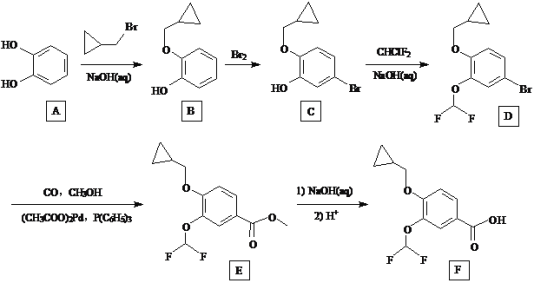
回答下列问题:
(1)A的化学名称为__________,D的分子式为__________
(2)由B生成C的化学方程式是____________。
(3)E→F的反应类型为___________,F中含氧官能团的名称为____________。
(4)上述合成路线中,有3步反应都使用NaOH溶液来提高产率,其原理是_______。
(5)![]() 的链状同分异构体有_______种(不包括立体异构),写出其中核磁共振氢谱有两组峰的结构简式:__________。
的链状同分异构体有_______种(不包括立体异构),写出其中核磁共振氢谱有两组峰的结构简式:__________。
(6)设计以对甲基苯酚为原料制备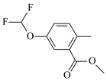 的合成路线:______(其他试剂任选)。
的合成路线:______(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com