
【题目】下列各图所示装置的气密性检查中,一定漏气的是( )
A. 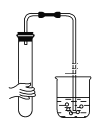 B.
B. 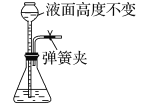
C. 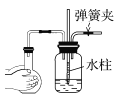 D.
D. 
【答案】D
【解析】
装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡,常见方法有:①利用压强差形成水柱;②利用气体的热胀冷缩形成压强差,形成气泡。
A项、用手握住试管,试管内气体受热膨胀,在烧杯内有气泡产生,说明装置气密性良好不漏气,故A正确;
B项、用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好不漏气,故B正确;
C项、用弹簧夹夹住右边导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中气体压强增大,在玻璃管中形成一段水柱,说明装置气密性良好不漏气,故C正确;
D项、用弹簧夹夹住右边导管,上下移动,若装置不漏气,两边液面应形成一定的高度差,而图示两端液面相平,说明装置漏气,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
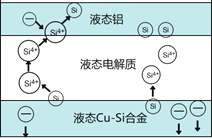
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
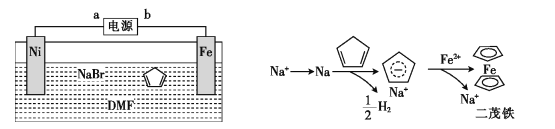
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质, A为是生产、生活中用量最大、用途最广的金属单质,室温下B是黄绿色气体,C为无色气体。在一定条件下相互转化的关系如图所示。
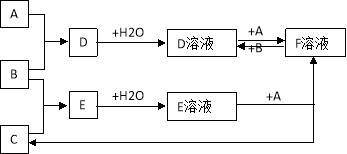
请回答以下问题:
(1)A、B、C分别是什么物质:A是 ,B是 ,C是,F是 (填化学式)
(2)写出A和B生成D的化学方程式: ,向D溶液中加
入 溶液可看到溶液变血红色。
(3)写出F溶液中加入B的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
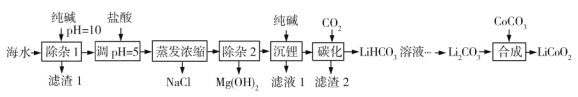
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2+O2![]() 2SO3,在一定温度下的定容容器中进行,下列说法正确的是
2SO3,在一定温度下的定容容器中进行,下列说法正确的是
A.反应达到限度时,各反应物和生成物的浓度之比等于化学计量数之比
B.反应达到限度时,SO2将全部转化为SO3
C.反应达到限度时,O2物质的量不再改变
D.反应达到限度时,v(正反应)=v(逆反应)=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
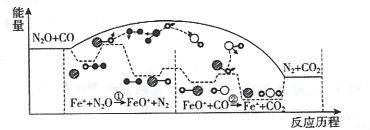
A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
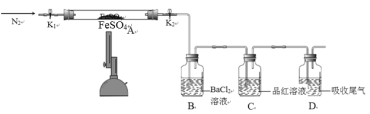
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.足量Zn与一定量的浓硫酸反应产生22.4L气体时,转移的电子数为2NA
B.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
C.过量的铁在1mol Cl2中然烧,最终转移电子数为2NA
D.由2H和18O所组成的水11 g,其中所含的中子数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com