
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
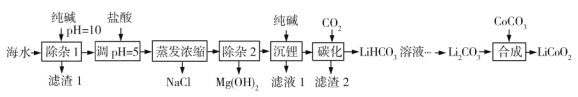
已知如下信息:
①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
②碳酸锂的溶解度与温度关系如图所示:

③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为________。滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和__________(填化学式)。
(2)调节pH=5的目的是__________。
(3)“沉锂”包括过滤、洗涤等,宜用_________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 |
| 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 10.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______(填序号)方案投料。
(4)“除杂2”中调pH=13时c(Mg2+)=_________mol·L-1。
(5)“合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式________。
(6)在“合成”中制备1 mol LiCoO2转移电子的物质的量为__________。
【答案】+3 MnCO3 除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3 热水 ③ 6.0×10-8 2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2 1mol
4LiCoO2+6CO2 1mol
【解析】
(1)LiCoO2中锂为+1价,氧为-2价,则钴为+3价。由表中溶度积知,碳酸锰难溶于水,因此滤渣1中主要有MgCO3、Mg(OH)2、CaCO3和MnCO3。。答案为:+3;MnCO3;
(2)加入盐酸除去过量的碳酸钠,否则碳酸锂会在浓缩时析出,损失锂元素。答案为:除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3;
(3)碳酸锂的溶解度随温度升高而减小,用热水洗涤比冷水好,减小锂元素损失。从投料比看出,序号③的比例中,投入碳酸钠量较小,锂回收率较高,可降低生产成本。答案为:热水;③;
(4)pH=13,c(OH-)=1×10-1 mol·L-1,c(Mg2)=![]() =6.0×10-8 mol·L-1。答案为:6.0×10-8;
=6.0×10-8 mol·L-1。答案为:6.0×10-8;
(5)在合成中钴的反应中钴的化合价升高,必有O2参与反应,副产物是CO2。答案为:2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2;
4LiCoO2+6CO2;
(6)Co元素化合价从+2升高到+3价,生成1 mol LiCoO2转移1 mol电子。答案为:1mol。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉设计了如图装置进行实验:
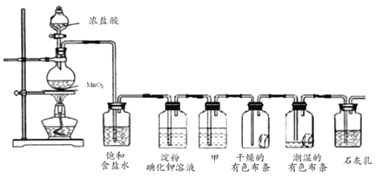
请按要求回答下列问题:
(1)圆底烧瓶中制氯气的化学方程式________;
(2)淀粉碘化钾溶液中观察到的现象是________;
(3)若干燥的有色布条不褪色潮湿的有色布条褪色,则甲中盛放________;
(4)![]() 与石灰乳反应制取漂白粉的化学方程式为________;
与石灰乳反应制取漂白粉的化学方程式为________;
(5)用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应;②用87g二氧化锰与足量的浓盐酸反应,则所得氯气________。
A.②比①多 B.①比②多 C.一样多 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是 ( )


A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B. Ⅱ图中:生成蓝色的烟
C. Ⅲ图中:用日光照射量筒,量筒中会产生大量白雾,液面会迅速上升
D. Ⅳ图中:a中有色布条褪色,b中不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 molN4(分子为正四面体结构)含共价键数目为2NA
B.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
C.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有4 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。
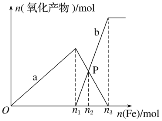
(1)b表示的关系曲线_______(填离子符号)
(2)n1=______
(3)P点时,n(Fe2+)=______mol
(4)向P点溶液中加入铜粉,最多可溶解________g
查看答案和解析>>
科目:高中化学 来源: 题型:
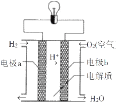
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Cu | 稀盐酸 | 偏向Cu |
2 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
回答下列(1)、(2)小题:
⑴实验1中Al作的电极为____(填“正极”或“负极”),Cu作的电极为____(填“正极"或“负极”)。
⑵实验2观察到C(石墨)棒上产生的现象是____,负极的电极反应式为____.如图是电解质为稀硫酸溶液的氢氧燃料电池。该电池的电子从电极____经过导线流向电极____(填a或b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com