
【题目】以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-l、-764.5kJ·mol-l。则反应I:CO(g)+2H2(g)=CH3OH(g)△H=___
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
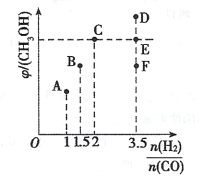
①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___(填“增大”、“减小”或“不变”)。
②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。
③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。
(3)在一容积可变的密闭容器中充有10molCO和20molH2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。
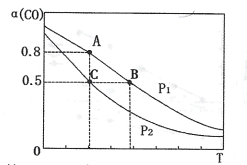
①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。
②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。
【答案】-90.1kJ/mol 不变 0.05mol·L-1·min-1 F > KA=KC>KB 2
【解析】
(1)CO、H2、CH3OH(g)的燃烧热化学方程式分别为:
①![]() ,
,
②![]() ,
,
③![]() ,根据盖斯定律可知,将①+2×②-③可得:
,根据盖斯定律可知,将①+2×②-③可得:![]() ;
;
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I![]() ;
;
①当起始n(H2)/n(CO)=1时,则n(H2)=n(CO)=1.5mol,CO的体积分数为50%,根据三等式
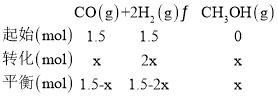
平衡时,CO的体积分数为![]() ,不管CO转化了多少,CO的体积分数一直为50%,则反应前后体积分数不变;
,不管CO转化了多少,CO的体积分数一直为50%,则反应前后体积分数不变;
②当起始n(H2)/n(CO)=2时,混合气体为3mol,则n(CO)=1mol,n(H2)=2mol,反应经过l0min达到平衡,CO转化率为0.5,即转化了0.5mol,则H2转化1mol,则0~l0min内平均反应速率v(H2)=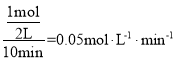 ;
;
③当反应物的投料比等于其化学计量数之比时,平衡时,生成物的体积分数最大,即当起始n(H2)/n(CO)=2时,CH3OH(g)的体积分数(φ)最大,因此当起始n(H2)/n(CO)= 3.5时,达到平衡后,CH3OH的体积分数可能是图像中的F点;
(3)①当温度相同时,增大压强,平衡正向移动,CO转化率上升,由此可知P1>P2;该反应正向为放热反应,升高温度,平衡将逆向移动,平衡常数将减小,平衡常数只与温度有关,温度不变时,平衡常数不变,A和C的温度相同,小于B的温度,因此KA=KC>KB;
②平衡状态A和C的温度相同,平衡常数相同。达到平衡状态C时,CO的转化率为50%,则平衡时n(CO)=5mol,n(H2)=10mol,n(CH3OH)=5mol,平衡常数![]() ,达到平衡状态A时,CO的转化率为80%,则平衡时n(CO)=2mol,n(H2)=4mol,n(CH3OH)=8mol,设该容器体积为VL,则
,达到平衡状态A时,CO的转化率为80%,则平衡时n(CO)=2mol,n(H2)=4mol,n(CH3OH)=8mol,设该容器体积为VL,则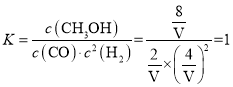 ,解得V=2。
,解得V=2。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
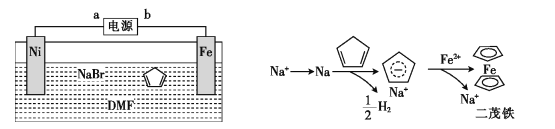
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为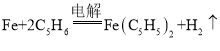
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
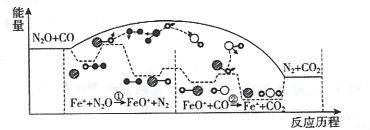
A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4用于治疗缺铁性贫血。为探究硫酸亚铁的分解产物,按如下装置进行实验。打开K1和K2,缓慢通入N2,加热。实验后反应管中残留固体为红色粉末。分析实验回答下列问题:
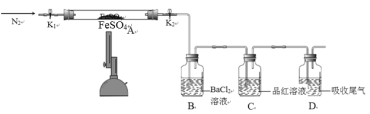
(1)加热前通入N2的目的是__________。
(2)实验过程中可观察到装置B中的现象为_____。C中观察到品红溶液褪色,则可证明混合气体中含有的物质是_____。
(3)反应后A中残留红色粉末的用途有__________(任写一条)。
(4)写出FeSO4高温分解反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】16mL由NO与NH3组成的混合气体在催化剂作用下于400℃左右可发生反应:6NO+4NH3![]() 5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3 ②3∶2 ③4∶3 ④9∶7。其中正确的是
A. ②③B. ③④C. ①②D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为______________。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为________。
Ⅱ.在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρ g·cm-3,计算该溶液的浓度(用以上字母表示)。
(1)该溶液的物质的量浓度________________
(2)该溶液的质量分数_________________________
Ⅲ.有两份溶液,其中所含溶质相同,设其摩尔质量为M g·mol-1。根据下表信息,回答有关问题:
溶质的质量分数 | 溶液的密度(g·cm-3) | |
第一份溶液 | w1 | ρ1 |
第二份溶液 | w2 | ρ2 |
(1)取等质量两份溶液混合,则所得混合液中溶质的质量分数w3=________。(用以上字母表示)
(2)若有w1>w2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为w4,若ρ1>ρ2,则w3___w4;若ρ1<ρ2,w3______w4(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
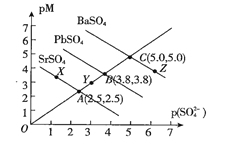
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.足量Zn与一定量的浓硫酸反应产生22.4L气体时,转移的电子数为2NA
B.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
C.过量的铁在1mol Cl2中然烧,最终转移电子数为2NA
D.由2H和18O所组成的水11 g,其中所含的中子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
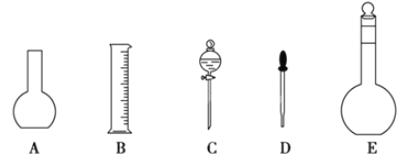
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的__(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是__(用字母表示,每个字母只能用一次)。
A 用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B 准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C 将容量瓶盖紧,摇匀
D 将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E 改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F 继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算,配制上述NaOH溶液需 NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com