
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
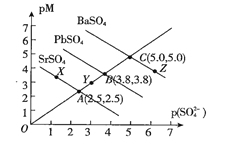
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
【答案】D
【解析】
A.硫酸根离子浓度和铅离子浓度乘积达到或大于PbSO4沉淀溶度积常数可以沉淀,一定条件下BaSO4可以转化成PbSO4,故A错误;
B.Z点对应的溶液为饱和溶液,溶液中钡离子浓度和硫酸根离子浓度乘积为常数,pM=-lgc(M),p(SO42-)=-lgc(SO42-),则c(Ba2+)>c(SO42-),同理X点饱和溶液中c(Sr2+)<c(SO42-),故B错误;
C.图象分析可知溶度积常数SrSO4、PbSO4、BaSO4分别为10-2.5×10-2.5、10-3.8×10-3.8、10-5×10-5,因此溶度积常数:BaSO4<PbSO4<SrSO4,因此在ToC时,用0.01mol·L-1Na2SO4溶液滴定20mL浓度均是0.01mol·L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Ba2+先沉淀,故C错误;
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为
BaSO4(s)+Pb2+(aq)的平衡常数为![]() =102.4,故D正确;
=102.4,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 molN4(分子为正四面体结构)含共价键数目为2NA
B.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
C.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16gcm﹣3)配制成1molL﹣1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为___的容量瓶。
(2)经计算需要___mL浓盐酸,在量取时宜选用下列量筒中的___。
A.5mL B.10mL C.25mL D.50mL
(3)从下列仪器中,不会用到的是___(选序号)。
①量筒 ②玻璃棒 ③药匙 ④容量瓶 ⑤烧杯 ⑥台秤 ⑦胶头滴管 ⑧细口试剂瓶 ⑨标签纸
(4)若实验过程遇到下列情况,对盐酸的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①容量瓶洗涤后仍少许蒸馏水,___;②未经冷却将溶液注入容量瓶中,___;
③摇匀后发现液面下降再加水,___;④定容时俯视观察液面,___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含1个碳原子物质(如CO、CO2、CH4、CH3OH等)为原料的“碳一化学”处于未来化学产业的核心,成为科学家研究的重要课题。请回答下列问题:
(1)已知CO、H2、CH3OH(g)的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-l、-764.5kJ·mol-l。则反应I:CO(g)+2H2(g)=CH3OH(g)△H=___
(2)在温度T时,向体积为2L恒容容器中充入3molCO和H2的混合气体,发生反应I,反应达到平衡时,CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如下图所示。
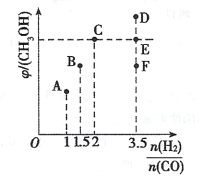
①当起始n(H2)/n(CO)=1时,从反应开始到平衡前,CO的体积分数将___(填“增大”、“减小”或“不变”)。
②当起始n(H2)/n(CO)=2时,反应经过l0min达到平衡,CO转化率为0.5,则0~l0min内平均反应速率v(H2)=___。
③当起始n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的__。(填“D”、“E”或“E”点)。
(3)在一容积可变的密闭容器中充有10molCO和20molH2,发生反应I。CO的平衡转化率(α)与温度(T)、压强(P)的关系如下图所示。
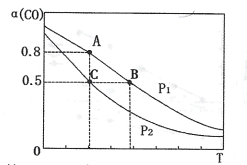
①压强P1=___(填“<”、“=”或“>”)P2;A、B、C三点的平衡常数KA、KB、KC的大小关系为___(用“<”、“=”或“>”表示)。
②若达到平衡状态C时,容器体积为10L,则在平衡状态A时容器体积为____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝碳酸镁 [AlaMgb(CO3)c(OH)deH2O] 用于治疗慢性胃炎。称取3.01 g铝碳酸镁样品,溶于50 mL 2 molL -1的盐酸(过量),收集到气体112 mL(标准状况);往所得溶液中加入40 mL 3 molL-1的NaOH溶液,过滤,将所得沉淀洗涤、干燥、称量得固体1.74 g;再将滤液稀释到100 mL,测得溶液中OHˉ的浓度为0.1 molL -1。由计算可得e的值为
A. 4B. 5C. 7D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A. 甘氨酸和氯乙烯都能通过聚合反应生成高分子化合物
B. 检测淀粉是否完全水解,向水解液中滴加碘水
C. 等质量的苯和苯乙烯(![]() )完全燃烧,消耗氧气的物质的量不相同
)完全燃烧,消耗氧气的物质的量不相同
D. 乙酸和葡萄糖都能与新制的氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)==CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) △H2=-41.2kJ/mol
T1°C时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
请回答下列问题:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=_____
(2)30s时CH4的转化率为_______,20~40s,v(H2)=_______.
(3)T2°C时,该反应的化学平衡常数为1.5,则T2___T1(填“>”“=”或 “<”。)
(4)T1°C时反应③达到平衡的标志为______________。
A.容器内气体密度不变 B.体系压强恒定
C.CO和H2的体积分数相等且保持不变 D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后/span>,其他条件不变,在70 s时再加入2 molCH4和1molCO2,此刻平衡的移动方向为________(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡____________(填“大”“小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1克氢气完全燃烧成水蒸气放出121kJ,1 mol O=O键完全断裂吸收496 kJ,1 mol H—O键形成时放出463 kJ,则氢气中1 mol H—H键断裂时吸收能量为( )
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com