
【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)==CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) △H2=-41.2kJ/mol
T1°C时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
请回答下列问题:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=_____
(2)30s时CH4的转化率为_______,20~40s,v(H2)=_______.
(3)T2°C时,该反应的化学平衡常数为1.5,则T2___T1(填“>”“=”或 “<”。)
(4)T1°C时反应③达到平衡的标志为______________。
A.容器内气体密度不变 B.体系压强恒定
C.CO和H2的体积分数相等且保持不变 D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后/span>,其他条件不变,在70 s时再加入2 molCH4和1molCO2,此刻平衡的移动方向为________(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡____________(填“大”“小”或“相等”)。
【答案】+247.6KJ/mol 23% 0.005mol/(L·s) > BC 正向 小
【解析】
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
(1)利用盖斯定律,将①-②,可得出热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H。
(2)利用三段式,建立各物质的起始量、变化量与平衡量的关系,可得出30s时CH4的转化率,20~40s的v(H2)。
(3)利用三段式,可求出T1时的化学平衡常数,与T2时进行比较,得出T2与T1的关系。
(4)A.气体的质量不变,容器的体积不变,则容器内气体密度始终不变;
B.容器的体积不变,气体的分子数随反应进行而发生变化;
C.平衡时,CO和H2的体积分数保持不变;
D.2v(CO)逆=v(CH4)正,方向相反,但数值之比不等于化学计量数之比。
(5)利用浓度商与平衡常数进行比较,可确定平衡移动的方向;利用等效平衡原理,可确定CO2的总转化率与原平衡时的关系。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
(1)利用盖斯定律,将①-②,可得出热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.6kJ/mol,故答案为:+247.6kJ/mol;
(2)利用表中数据,建立如下三段式:
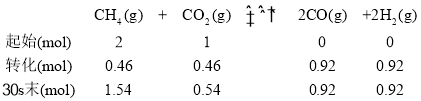
30s时,CH4的转化率为![]() =23%,20~40s的v(H2)=
=23%,20~40s的v(H2)=![]() = 0.005mol/(Ls),故答案为:23%;0.005mol/(Ls);
= 0.005mol/(Ls),故答案为:23%;0.005mol/(Ls);
(3)利用平衡时的数据,可求出T1时的化学平衡常数为![]() <1.5,则由T1到T2,平衡正向移动,从而得出T2>T1,故答案为:>;
<1.5,则由T1到T2,平衡正向移动,从而得出T2>T1,故答案为:>;
(4)A.反应前后气体的总质量不变,容器的体积不变,则容器内气体密度始终不变,则密度不变时,不一定达平衡状态,A不合题意;
B.气体的分子数随反应进行而发生改变,则压强随反应进行而改变,压强不变时达平衡状态,B符合题意;
C.平衡时,CO和H2的体积分数保持不变,反应达平衡状态,C符合题意;
D.2v(CO)逆=v(CH4)正,速率方向相反,但数值之比不等于化学计量数之比,反应未达平衡,D不合题意;
故答案为:BC;
(5)平衡时加入2molCH4和1molCO2,浓度商为Q=![]() ,所以平衡正向移动;加入2molCH4和1molCO2,相当于原平衡体系加压,平衡逆向移动,CO2的总转化率比原平衡小,故答案为:正向;小。
,所以平衡正向移动;加入2molCH4和1molCO2,相当于原平衡体系加压,平衡逆向移动,CO2的总转化率比原平衡小,故答案为:正向;小。


科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生可逆反应的能量变化及反应历程如图所示。下列说法不正确的是
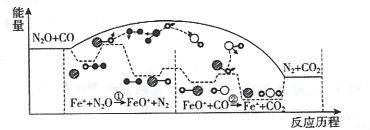
A.反应中Fe+是催化剂,FeO+是中间产物B.总反应速率由反应②的速率决定
C.升高温度,总反应的平衡常数K减小D.当有14g N2生成时,转移1mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃下,三种硫酸盐MSO4,(M表示Pb2+或Ba2+或Sr2+)的沉淀溶解平衡曲线如图所示。已知pM=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
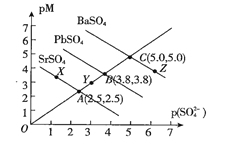
A.BaSO4在任何条件下都不可能转化成PbSO4
B.X点和Z点分别是SrSO4和BaSO4的饱和溶液,对应的溶液中c(M)=c(SO42-)
C.在ToC时,用0.01mol.L-1Na2SO4溶液滴定20mL浓度均是0.01mol.L-1的Ba(NO3)2和Sr(NO3)2的混合溶液,Sr2+先沉淀
D.ToC下,反应PbSO4(s)+Ba2+(aq)![]() BaSO4(s)+Pb2+(aq)的平衡常数为102.4
BaSO4(s)+Pb2+(aq)的平衡常数为102.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.足量Zn与一定量的浓硫酸反应产生22.4L气体时,转移的电子数为2NA
B.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为4NA
C.过量的铁在1mol Cl2中然烧,最终转移电子数为2NA
D.由2H和18O所组成的水11 g,其中所含的中子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是
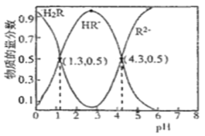
A.在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-)
B.等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小
C.在pH=3的溶液中存在![]()
D.向Na2CO3溶液中加入过量H2R溶液,发生反应:CO32-+H2R=HCO3-+HR-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
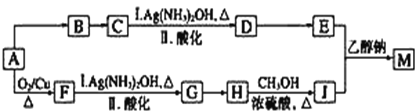
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
②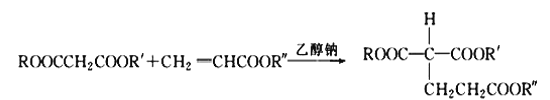 (R、R′、R″代表相同或不相同的烃基)。
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是_________。
(2)A→B反应所需的试剂是_________。
(3)G→H反应的化学方程式是______。
(4)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(5)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有_______种,其中任意1种的结构简式是__________。
(6)J可合成高分子化合物,该高分子化合物的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2 mol·L-1的NaOH溶液450 mL和0.5 mol·L-1的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
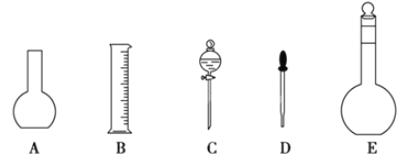
(1)如图所示的仪器中配制溶液肯定不需要的是__(填序号),配制上述溶液还需用到的玻璃仪器是__(填仪器名称)。
(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的__(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是__(用字母表示,每个字母只能用一次)。
A 用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B 准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50 mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C 将容量瓶盖紧,摇匀
D 将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E 改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F 继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(4)根据计算,配制上述NaOH溶液需 NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com