
【题目】二甲胺[(CH3)2NH]在水中电离与氨相似,![]() 。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
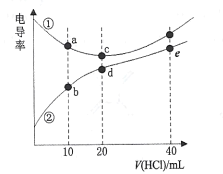
A.b点溶液:![]()
B.d点溶液:![]()
C.e点溶液中:![]()
D.a、b 、c、d点对应的溶液中,水的电离程度:![]()
【答案】D
【解析】
NaOH是强碱,二甲胺是弱碱,则相同浓度的NaOH和二甲胺,溶液导电率:NaOH>(CH3)2NH,所以①曲线表示NaOH滴定曲线、②曲线表示(CH3)2NH滴定曲线,然后结合相关守恒解答。
A.b点溶液中溶质为等物质的量浓度的(CH3)2NH·H2O和(CH3)2NH2Cl,![]() ,(CH3)2NH2Cl的水解常数
,(CH3)2NH2Cl的水解常数![]() ,所以(CH3)2NH·H2O的电离程度大于(CH3)2NH2Cl的水解程度导致溶液呈碱性,但是其电离和水解程度都较小,则溶液中微粒浓度存在:
,所以(CH3)2NH·H2O的电离程度大于(CH3)2NH2Cl的水解程度导致溶液呈碱性,但是其电离和水解程度都较小,则溶液中微粒浓度存在:![]() ,A错误;
,A错误;
B.d点二者完全反应生成(CH3)2NH2Cl,![]() 水解生成等物质的量的
水解生成等物质的量的![]() 和H+,
和H+,![]() 水解程度远大于水的电离程度,因此
水解程度远大于水的电离程度,因此![]() 与
与![]() 近似相等,该溶液呈酸性,因此
近似相等,该溶液呈酸性,因此![]() ,则
,则![]() , 溶液中存在电荷守恒:
, 溶液中存在电荷守恒:![]() ,因此
,因此![]() ,故B错误;
,故B错误;
C.e点溶液中溶质为等物质的量浓度的(CH3)2NH2Cl、HCl,溶液中存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ,则
,则![]() ,故C错误;
,故C错误;
D.酸或碱抑制水电离,且酸中c(H+)越大或碱中c(OH)越大其抑制水电离程度越大,弱碱的阳离子或弱酸的阴离子水解促进水电离,a点溶质为等浓度的NaOH和NaCl;b点溶质为等物质的量浓度的[(CH3)2]NH·H2O和(CH3)2NH2Cl,其水溶液呈碱性,且a点溶质电离的OH-浓度大于b点,水的电离程度:b>a;c点溶质为NaCl,水溶液呈中性,对水的电离无影响;d点溶质为(CH3)2NH2Cl,促进水的电离,a、b点抑制水电离、c点不影响水电离、d点促进水电离,所以水电离程度关系为:d>c>b>a,故D正确;
故案为:D。


科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体。某同学采用12.0mL96%密度为1.05g/mL的乙酸、23mL95%密度为0.75g/mL的乙醇、12.0mL浓硫酸、饱和Na2CO3溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.2 |

①先向蒸馏烧瓶B中加入试剂__,然后通过仪器A慢慢加入__;
②加热保持油浴温度为135~145℃,至不再有液体流出后,停止加热;
③取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,再将混合物分液,弃去水层,得到有机层。
试回答下列问题:
(1)①蒸馏烧瓶B加入试剂__,然后通过仪器A慢慢加入__。
(2)写出制备乙酸乙酯的化学方程式__。
(3)仪器A的名称是__;浓硫酸的作用是__;仪器C的作用是__。
(4)反应中所用的乙醇是过量的,其目的是__。
(5)③中加入饱和碳酸钠溶液的作用__,分批、少量、多次地加入饱和碳酸钠的原因是__。
(6)从③中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__,再加入无水硫酸钠,然后进行蒸馏,收集77.2℃的馏分,以得到纯净的乙酸乙酯9.2g,计算此实验中生成乙酸乙酯的产率为__(写出计算的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轴烯(Radialene)是一类独特的环状烯烃,其环上每一个碳原子都接有一个双键,含n元环的轴烯可以表示为[ n]轴烯,如下图是三种简单的轴烯。下列有关说法不正确的是
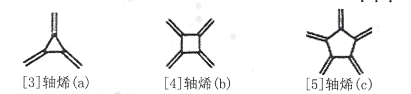
A.a分子中所有原子都在同一个平面上B.b能使酸性KMnO4溶液褪色
C.c与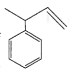 互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成与开发大量自然界并不存在的新物质、新材料,并为人类服务是现代化学的重要任务。请结合所学知识回答下列问题:
(1)沙滩上沙粒的主要成分是____。工业上可用沙粒的主要成分与纯碱在高温下反应制备Na2SiO3,该反应的化学方程式为____。
(2)氯气溶于水能杀菌消毒,在新制氯水中滴入紫色石蕊试液的现象是___,该现象说明氯水中含有_______(填化学式或离子符号)。
(3)直接用氯气作漂白剂,难以保存,效果不理想。经过多年的实验、改进,目前常用的是漂白粉。工业制取漂白粉的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物之间可以相互转化,请按照要求回答下列问题:
(1)下列有关NO和NO2的描述正确的是__________(填标号)。
a.均为无色气体 b.均为大气污染物 c.可用排水集气法收集NO
(2)写出二氧化氮与水反应的化学方程式_______,其中被氧化的N与被还原的N的物质的量之比为__________。
(3)如下是生成NO2的几个化学反应:
①2NO+O2=2NO2 ②Fe+ 6HNO3(浓)= Fe (NO3)3 + 3NO2↑+3H2O ③4HNO3![]() O2↑+4NO2↑+2H2O ④N2O4
O2↑+4NO2↑+2H2O ④N2O4![]() 2NO2
2NO2
其中体现N元素还原性的是_____ (填标号,下同),体现N元素氧化性的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
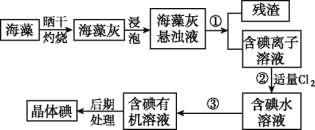
(1)实验室灼烧海藻,需要下列仪器中的____(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①_____________,③______。
(3)提取碘的过程中,可选择的有机试剂是_____。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)小组用CCl4萃取碘水中的碘,在分液漏斗中进行,下层液体呈____色;他们打开分液漏斗活塞,却未见液体流下,原因可能是____________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
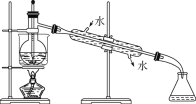
①________; ② _________; ③_________。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___________,最后晶态碘在____里聚集。
Ⅱ.海水开发利用可以提取NaCl和Mg(OH)2。
(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过溶解、________、_________等操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
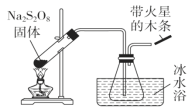
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com