
【题目】Ⅰ.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
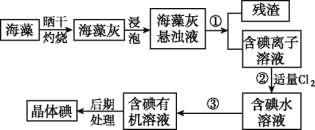
(1)实验室灼烧海藻,需要下列仪器中的____(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①_____________,③______。
(3)提取碘的过程中,可选择的有机试剂是_____。
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)小组用CCl4萃取碘水中的碘,在分液漏斗中进行,下层液体呈____色;他们打开分液漏斗活塞,却未见液体流下,原因可能是____________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
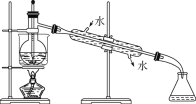
①________; ② _________; ③_________。
(6)进行上述蒸馏操作时,使用水浴加热的原因是___________,最后晶态碘在____里聚集。
Ⅱ.海水开发利用可以提取NaCl和Mg(OH)2。
(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过溶解、________、_________等操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______。
【答案】cdef 过滤 萃取分液 B 紫红 分液漏斗上口活塞凹槽未对准分液漏斗上口小孔 缺石棉网 温度计插到了液体中 冷凝管进出水的方向颠倒 使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧瓶 蒸发结晶 趁热过滤 取最后的洗液,滴加Na2CO3溶液,若不出现白色沉淀则洗净
【解析】
Ⅰ.(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚;
(2)分离难溶性固体和溶液采用过滤方法,从碘水中分离出碘采用分液方法;
(3)萃取剂的选取标准:和原溶剂不互溶,和溶质不反应,溶质在萃取剂中的溶解度大于在水中的溶解度;
(4)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方、水在上方;如果分液漏斗上口活塞小孔未与空气相通,则液体不会流出;
(5)温度计测量馏分温度,冷凝管中的水遵循“下进上出”原则,加热烧瓶需要垫石棉网;
(6)水浴加热时烧瓶受热均匀,且温度不至于过高;
Ⅱ.(1) NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过蒸发结晶的方法分离提纯;
(2)检验最后一次洗涤液中有没有Ca2+。
Ⅰ.(1)灼烧海带需要的仪器有:酒精灯、三脚架、泥三角及坩埚,故选cdef;
(2)分离难溶性固体和溶液采用过滤方法,从碘水中分离出碘采用萃取分液方法,所以①的操作名称是过滤,③的操作名称是萃取分液;
(3)A.酒精和水互溶,所以不能作萃取剂,故错误;
B.四氯化碳、苯符合萃取剂条件,所以能作萃取剂,故正确;
C.乙酸和水互溶,所以乙酸不能作萃取剂,故错误;
D.甘油和水互溶,所以甘油不能作萃取剂,故错误;
故答案为B;
(4)四氯化碳的密度大于水且和水不互溶,四氯化碳能萃取碘,所以有机层在下方、水在上方,碘的四氯化碳溶液呈紫色;如果分液漏斗上口活塞小孔未与空气相通,则液体不会流出;
(5)温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处;冷凝管中的水遵循“下进上出”原则,否则易炸裂冷凝管;加热烧瓶需要垫石棉网,否则,烧瓶受热不均匀;
(6)水浴加热时烧瓶受热均匀,且温度不至于过高而使碘转化为气态,最后碘在蒸馏烧瓶内聚集;
Ⅱ.(1)借助溶解、蒸发结晶、趁热过滤等操作可除去NaCl中若混有的少量KClO3固体;
(2) 检验沉淀是否洗净的操作方法是取最后一次的洗涤液,滴加Na2CO3溶液,若不出现白色沉淀则洗净。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
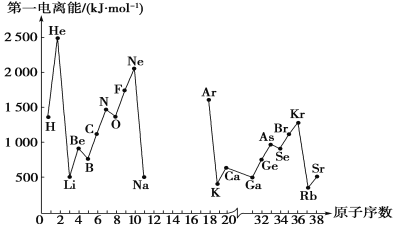
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为____<Al<__;(填元素符号)
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是_____。
(3)上图中第一电离能最小的元素在周期表中的位置是第________周期________族;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲胺[(CH3)2NH]在水中电离与氨相似,![]() 。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
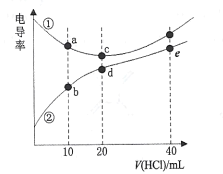
A.b点溶液:![]()
B.d点溶液:![]()
C.e点溶液中:![]()
D.a、b 、c、d点对应的溶液中,水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeS溶于盐酸中,生成FeCl2和H2S气体。现将100mL2.0mol/L的盐酸加入到一定量的FeS固体中,以制备H2S气体。当盐酸完全反应后假定溶液体积不变。
试计算:(1)可收集到的H2S气体在标准状况下的体积___________________;
(2)反应后溶液中FeCl2的物质的量浓度_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于①放热反应 ②吸热反应
A:分解反应 B:化合反应C:置换反应
(1)氯酸钾分解制氧气,既是_______(填①或②)又是______。(填A或B或C,下同)
(2)生石灰跟水反应生成熟石灰,既是_______又是______。
(3)锌粒与稀硫酸的反应,既是_______又是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝碳酸镁 [AlaMgb(CO3)c(OH)deH2O] 用于治疗慢性胃炎。称取3.01 g铝碳酸镁样品,溶于50 mL 2 molL -1的盐酸(过量),收集到气体112 mL(标准状况);往所得溶液中加入40 mL 3 molL-1的NaOH溶液,过滤,将所得沉淀洗涤、干燥、称量得固体1.74 g;再将滤液稀释到100 mL,测得溶液中OHˉ的浓度为0.1 molL -1。由计算可得e的值为
A. 4B. 5C. 7D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
① 高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于_______(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
② 高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是_______(填字母)。
a.铜 b.石墨 c.二氧化硅
③ 高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和_________(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
① 在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是____。(填元素符号)
② 下列物质中,具有抗菌消炎疗效的是____(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③ 如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是_____,属于着色剂的是_____,属于防腐剂的是_____。

(3)为了减轻我市的雾霾状况,《苏州市市区禁止燃放烟花爆竹规定》明确规定,自2017年1月1日起,姑苏区全区,苏州工业园区、高新区、吴中区、相城区、吴江区各区部分区域禁止燃放烟花爆竹。
① 燃煤是形成雾霾天气的罪魁祸首之一。向煤中加入一定量的石灰石进行“____”处理,可以减少SO2的排放。该反应的化学方程式为_____________________。
② 汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为____________。
③ 含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,制定的方案是先用(NH4)2Fe(SO4)2将Cr2O![]() 转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热,小木条不燃烧,说明Na2SiO3可作防火剂
B.二氧化硅既能与氢氟酸反应又能与![]() 溶液反应,所以二氧化硅是两性氧化物
溶液反应,所以二氧化硅是两性氧化物
C.![]() 是酸性氧化物,可以用澄清石灰水来鉴别
是酸性氧化物,可以用澄清石灰水来鉴别![]() 与
与![]()
D.自然界中不存在游离态的硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com