
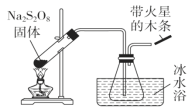
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
【答案】试管口应该略向下倾斜 冷却并收集SO3 木条复燃 2Mn2++5S2O![]() +8H2O
+8H2O![]() 2MnO
2MnO![]() +10SO
+10SO![]() +16H+ S2O
+16H+ S2O![]() MnO 用玻璃棒引流,向漏斗中加蒸馏水至没过沉淀,使蒸馏水自然流下,重复操作2~3次(合理即可) 0.06 偏高
MnO 用玻璃棒引流,向漏斗中加蒸馏水至没过沉淀,使蒸馏水自然流下,重复操作2~3次(合理即可) 0.06 偏高
【解析】
(1)在试管中加热固体时,试管口应略微向下倾斜;根据SO3、氧气的性质进行分析;
(2)X为MnO4-,向所得溶液中加入BaCl2溶液可以产生白色沉淀,则产物中有SO42-,据此写出离子方程式,并根据氧化还原反应规律判断氧化剂、氧化产物;
(3)根据沉淀洗涤的方法进行回答;
(4)根据得失电子守恒可得到关系式:5H2C2O4---2MnO4-,带入数值进行计算;Na2S2O8也具有氧化性,氧化H2C2O4。
(1)在试管中加热固体时,试管口应略微向下倾斜,SO3的熔、沸点均在0℃以上,因此冰水浴有利于将SO3冷却为固体,便于收集SO3,由Na2S2O8的分解原理可知,生成物中有氧气,所以在导管出气口的带火星的木条会复燃,故答案为:试管口应该略向下倾斜;冷却并收集SO3;木条复燃;
(2)X为MnO4-,向所得溶液中加入BaCl2溶液可以产生白色沉淀,则产物中有SO42-,则反应的离子方程式为2Mn2++5S2O![]() +8H2O
+8H2O![]() 2MnO
2MnO![]() +10SO
+10SO![]() +16H+,根据该反应中元素化合价的变化可知,氧化剂是S2O82-,氧化产物是MnO4-,故答案为:2Mn2++5S2O
+16H+,根据该反应中元素化合价的变化可知,氧化剂是S2O82-,氧化产物是MnO4-,故答案为:2Mn2++5S2O![]() +8H2O
+8H2O![]() 2MnO
2MnO![]() +10SO
+10SO![]() +16H+;S2O82-;MnO4-;
+16H+;S2O82-;MnO4-;
(3)沉淀洗涤时,需要用玻璃棒引流,并且所加蒸馏水需要没过沉淀,需要洗涤2~3次,故答案为:用玻璃棒引流,向漏斗中加蒸馏水至没过沉淀,使蒸馏水自然流下,重复操作2~3次(合理即可);
(4)根据得失电子守恒可得到关系式:

则![]() ,Na2S2O8具有氧化性,消耗的H2C2O4溶液增多,导致测得的结果偏高,故答案为:0.06;偏高。
,Na2S2O8具有氧化性,消耗的H2C2O4溶液增多,导致测得的结果偏高,故答案为:0.06;偏高。


科目:高中化学 来源: 题型:
【题目】二甲胺[(CH3)2NH]在水中电离与氨相似,![]() 。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
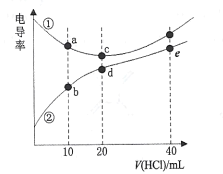
A.b点溶液:![]()
B.d点溶液:![]()
C.e点溶液中:![]()
D.a、b 、c、d点对应的溶液中,水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
① 高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于_______(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
② 高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是_______(填字母)。
a.铜 b.石墨 c.二氧化硅
③ 高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和_________(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
① 在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是____。(填元素符号)
② 下列物质中,具有抗菌消炎疗效的是____(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③ 如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是_____,属于着色剂的是_____,属于防腐剂的是_____。

(3)为了减轻我市的雾霾状况,《苏州市市区禁止燃放烟花爆竹规定》明确规定,自2017年1月1日起,姑苏区全区,苏州工业园区、高新区、吴中区、相城区、吴江区各区部分区域禁止燃放烟花爆竹。
① 燃煤是形成雾霾天气的罪魁祸首之一。向煤中加入一定量的石灰石进行“____”处理,可以减少SO2的排放。该反应的化学方程式为_____________________。
② 汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为____________。
③ 含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,制定的方案是先用(NH4)2Fe(SO4)2将Cr2O![]() 转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热,小木条不燃烧,说明Na2SiO3可作防火剂
B.二氧化硅既能与氢氟酸反应又能与![]() 溶液反应,所以二氧化硅是两性氧化物
溶液反应,所以二氧化硅是两性氧化物
C.![]() 是酸性氧化物,可以用澄清石灰水来鉴别
是酸性氧化物,可以用澄清石灰水来鉴别![]() 与
与![]()
D.自然界中不存在游离态的硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如下图所示:
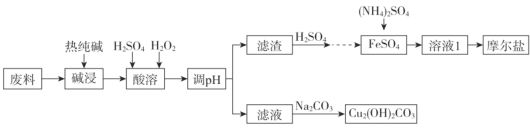
已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是_______________,H2O2的电子式为___________。
(2)调pH步骤可选用的试剂为______________。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是_______________。
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是____________________________________。
(5)写出该流程中生成碱式碳酸铜的离子方程式________________________________。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯毗格雷(clopidogrel)是一种用于抑制血小板聚集的药物,以2-氯苯甲醛为原料的合成路线如下:

(1)分子C中能团名称为__________,氯吡格雷的分子式为____________。
(2)X的结构简式为_____________。
(3)两分子C可在一定条件下反应,生成的有机产物中含有3个六元环,写出该反应的化学方程式:_____________________。
(4)物质D的某种同分异构体G满足以下条件:
① 苯环上有两个取代基,且其中一个取代基不含碳原子;② 与D中的官能团相同;③G能发生银镜反应;则符合条件的G有_______种。
(5)已知:![]()
在下列方框内写出由乙烯-甲醇为有机原料制备化合物![]() 的合成路线流程图(无机试剂任选),并标出每步对应的反应类型。_____________________示例如下:
的合成路线流程图(无机试剂任选),并标出每步对应的反应类型。_____________________示例如下:
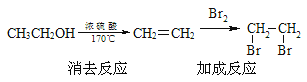
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式 | |||
|
|
|
|
铁器在具有![]() 、_____等环境中容易被腐蚀。
、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.![]() 转化为
转化为![]() 。
。
Ⅱ.![]() 在自然环境中形成
在自然环境中形成![]() ,该物质中铁元素的化合价为_______。
,该物质中铁元素的化合价为_______。
Ⅲ.![]() 和
和![]() 反应形成致密的
反应形成致密的![]() 保护层,
保护层,![]() 的作用是_______。
的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.![]() 保护层被氧化为
保护层被氧化为![]() ,如此往复腐蚀,___
,如此往复腐蚀,___![]() +___
+___![]() +___
+___![]()
![]() ____
____![]() (将反应补充完整)
(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成![]() 保护层,法如下: 将铁器浸没在盛有
保护层,法如下: 将铁器浸没在盛有![]() 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用![]() 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:![]() 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较![]() 与
与![]() 溶解度的大小:__________较大。[填
溶解度的大小:__________较大。[填![]() 与
与![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
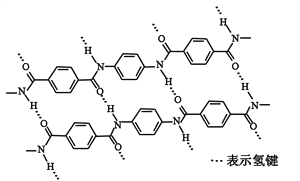
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com