
【题目】垃圾分类正在全国逐渐推广,垃圾资源化是可持续、绿色发展的重要途径。由金属废料(主要含铁、铜和它们的氧化物)制得碱式碳酸铜和摩尔盐[(NH4)2SO4·FeSO4·xH2O]的工艺流程如下图所示:
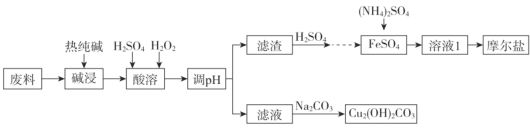
已知:Ksp[Fe(OH)3]=1×10-38 ,Ksp[Cu(OH)2]= 2.2×10-21,一般认为某离子浓度小于或等于10-5mol/L时,该离子转化或去除完全。
请回答下列问题:
(1)热纯碱的作用是_______________,H2O2的电子式为___________。
(2)调pH步骤可选用的试剂为______________。
A.CuO B.Cu(OH)2 C.Fe2O3 D.Fe(OH)3
(3)若所得溶液中c(Cu2+)=0.22 mol·L-1,则需要调节的pH范围是_______________。
(4)溶液1经过加热、蒸发至溶液中出现晶体时,自然冷却即可得到晶体,然后抽滤,用酒精洗涤晶体,酒精洗涤的目的是____________________________________。
(5)写出该流程中生成碱式碳酸铜的离子方程式________________________________。
(6)取3.92g摩尔盐产品,在隔绝空气的条件下加热至135°C时完全失去结晶水,此时固体质量为2.84g,则该摩尔盐结晶水个数x=________。
【答案】去除废料表面的油污 ![]() AB 3~4 除去晶体表面水分 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑) 6
AB 3~4 除去晶体表面水分 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑) 6
【解析】
加入热的纯碱液,金属废料(主要含铁、铜和它们的氧化物)中的主要成分都不发生反应,所以热的纯碱液的作用只能是去除油污;加入H2SO4、H2O2,铁及氧化物溶解并转化为Fe3+,铜及氧化物溶解生成Cu2+;调pH将Fe3+转化为Fe(OH)3沉淀,用硫酸溶解生成硫酸铁,再加入还原铁粉转化为硫酸亚铁,加入硫酸铵最后得摩尔盐。滤液中含有Cu2+,加入Na2CO3溶液发生双水解反应生成Cu2(OH)2CO3。
(1)由以上分析可知,利用热的纯碱溶液水解使溶液呈较强的碱性,从而达到去除油污的目的,其作用是去除废料表面的油污,H2O2为共价化合价,既存在O—H共价键,又存在O—O共价键,其电子式为![]() 。答案为:去除废料表面的油污;
。答案为:去除废料表面的油污;![]() ;
;
(2)调pH的目的,是将Fe3+转化为Fe(OH)3沉淀,同时不引入新的杂质,可选择CuO、Cu(OH)2,所以可选用的试剂为AB,故答案为:AB;
(3)Ksp[Fe(OH)3]=1×10-38,c(Fe3+)=10-5mol/L,c(OH-)=10-11mol/L,pH=3;若所得溶液中c(Cu2+)=0.22mol·L-1,利用Ksp[Cu(OH)2]=2.2×10-20,可求得c(OH-)=![]()
![]() mol/L,pH=-lg(10-4)=4,则需要调节的pH范围是3~4,故答案为:3~4;
mol/L,pH=-lg(10-4)=4,则需要调节的pH范围是3~4,故答案为:3~4;
(4)自然冷却即可得到晶体,然后抽滤;防烘干时晶体易失去结晶水,所以不能采用烘干的方法,而应用酒精洗涤晶体,酒精洗涤的目的是除去晶体表面水分,故答案为:除去晶体表面水分;
(5)该流程中Cu2+,加入Na2CO3溶液,利用部分离子发生双水解反应生成Cu2(OH)2CO3,离子方程式为2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑),故答案为:2Cu2++3CO32-+2H2O=Cu2(OH)2CO3↓+2HCO3-(或2Cu2++2CO32-+H2O=Cu2(OH)2CO3↓+CO2↑);
(6)m[(NH4)2SO4·FeSO4]= 2.84g,n[(NH4)2SO4·FeSO4]=![]() =0.01mol,m(H2O)= 3.92g-2.84g=1.08g,n(H2O)=
=0.01mol,m(H2O)= 3.92g-2.84g=1.08g,n(H2O)=![]() =0.06mol,则该摩尔盐结晶水个数x=
=0.06mol,则该摩尔盐结晶水个数x=![]() =6,故答案为:6。
=6,故答案为:6。


科目:高中化学 来源: 题型:
【题目】轴烯(Radialene)是一类独特的环状烯烃,其环上每一个碳原子都接有一个双键,含n元环的轴烯可以表示为[ n]轴烯,如下图是三种简单的轴烯。下列有关说法不正确的是
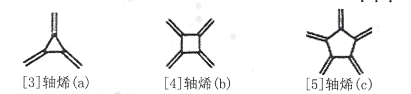
A.a分子中所有原子都在同一个平面上B.b能使酸性KMnO4溶液褪色
C.c与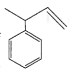 互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用打磨过的铝片进行如下实验,下列分析不合理的是( )
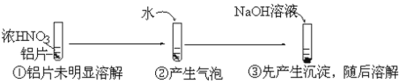
A.①中铝片发生了钝化
B.②中产生的气泡是氮氧化合物,不是氢气
C.③中沉淀溶解的离子方程式是![]()
D.②中加水稀释过程中,仅发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: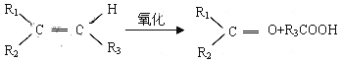
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8![]() 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。
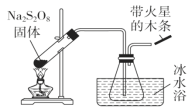
(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
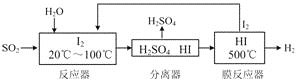
下列说法正确的是
A. 分离器中物质分离的操作为过滤
B. 该工艺中I2和HI的相互转化体现了“碘循环”
C. 反应器和膜反应器中分别发生了非氧化还原反应和氧化还原反应
D. 碘循环工艺的总反应为2SO2 + 4H2O + I2 == H2+ 2H2SO4+ 2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=___。
(2)丙溶液中存在的电离平衡为___(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液,下列各量随水量的增加而增大的是___(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)最大的是___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=___。
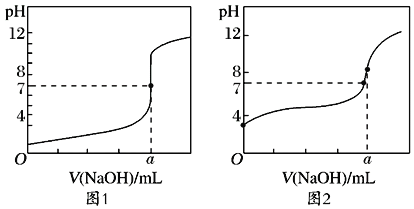
(6)图___(填1或2)表示NaOH溶液滴定CH3COOH溶液的过程。
(7)图2中a点对应的溶液pH=8,原因是___(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期主族元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是( )
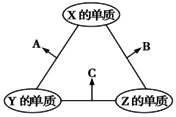
A.X元素位于第VIA族B.A不能溶于B中
C.A是典型的酸性氧化物D.B的沸点高于C的沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com