
����Ŀ�������ڹʹ������չʾ��ר�Ҿ�տ�ļ��պͶԴ�ͳ�Ļ����Ȱ�����أ�Ҳ������ᵽ��ѧ���������ﱣ���еľ����ã�ij����������������Ĺ������£�
(1)�����ʴ����
��Ҫ�ɷֵĻ�ѧʽ | |||
|
|
|
|
�����ھ���![]() ��_____�Ȼ��������ױ���ʴ��
��_____�Ȼ��������ױ���ʴ��
(2)������ʴԭ����һ����Ϊ�������������¸�ʴѭ����
��![]() ת��Ϊ
ת��Ϊ![]() ��
��
��![]() ����Ȼ�������γ�
����Ȼ�������γ�![]() ������������Ԫ�صĻ��ϼ�Ϊ_______��
������������Ԫ�صĻ��ϼ�Ϊ_______��
��![]() ��
��![]() ��Ӧ�γ����ܵ�
��Ӧ�γ����ܵ�![]() �����㣬
�����㣬![]() ��������_______��
��������_______��
a�������� b����ԭ�� c���Ȳ���������Ҳ���ǻ�ԭ��
����![]() �����㱻����Ϊ
�����㱻����Ϊ![]() �����������ʴ��___
�����������ʴ��___![]() +___
+___![]() +___
+___![]()
![]() ____
____![]() (����Ӧ��������)
(����Ӧ��������)
(3)�о����֣�Cl-�����ĸ�ʴ���������Ӱ�졣��ѧ�������ȡ���ԭ���γ�![]() �����㣬�����£� ��������û��ʢ��
�����㣬�����£� ��������û��ʢ��![]() ��Һ�������У����������� 60��90�档һ��ʱ�䣬 ȡ�������
��Һ�������У����������� 60��90�档һ��ʱ�䣬 ȡ�������![]() ��Һϴ������Cl-��
��Һϴ������Cl-��
�ټ��ϴ��Һ�� Cl-�ķ�����_____��
�����ȷ�Ӧ��![]() �����ӷ�Ӧ�ı���������Ũ�ȵļ�С���Ƚ�
�����ӷ�Ӧ�ı���������Ũ�ȵļ�С���Ƚ�![]() ��
��![]() �ܽ�ȵĴ�С��__________�ϴ�[��
�ܽ�ȵĴ�С��__________�ϴ�[��![]() ��
��![]() ]
]
���𰸡�H2O��ʪ +3 c 4 1 6 12 ȡ����ϴ��Һ���Թ��У�����ϡ������������Ļ��Һ�����ް�ɫ��������˵����Cl- FeOCl
��������
��1�������ڳ�ʪ�Ļ����к����������绯��ʴ�������⣬�����ھ���O2��H2O �Ȼ��������ױ���ʴ����ΪH2O����ʪ����
��2��II�����ݻ�������Ԫ�ػ��ϼ۴�����Ϊ0������FeO(OH)����Ԫ�صĻ��ϼ�Ϊ+3����Ϊ+3��
III��FeO(OH)��Fe2+��Ӧ�γ����ܵ�Fe3O4�����㣬��������������Fe2O3FeO������Fe2+�Ȳ���������Ҳ���ǻ�ԭ������ѡc����Ϊc��
IV����Ӧ��O2��OԪ�صĻ��ϼ۽���4��Fe3O4��3��Fe�Ļ��ϼ۹�����1�����ݻ��ϼ������غ��֪��Fe3O4�ļ�����Ϊ4��O2�ļ�����Ϊ1�����ԭ���غ���ƽ�õ���Ӧ�Ļ�ѧ����ʽΪ��4Fe3O4+O2+6H2O=12FeO(OH)����Ϊ4��1��6��12��
��3���ټ���Cl-���������ữ����������Һ������Ϊ��ȡ����ϴ��Һ���Թ��У�����ϡ�����ữ����������Һ�����ް�ɫ����������˵����Cl-����Ϊȡ����ϴ��Һ���Թ��У�����ϡ�����ữ����������Һ�����ް�ɫ����������˵����Cl-��
�ڻ�ѧ��Ӧ�д��ܽ��С������ת��Ϊ�ܽ�ȸ�С�����ƣ����ڲ�����FeOCl��FeO(OH)������FeOCl���ܽ�ȴ���FeO(OH)����ΪFeOCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����֮������ת�����밴��Ҫ��ش��������⣺
(1)�����й�NO��NO2��������ȷ����__________(����)��
a����Ϊ��ɫ���� b����Ϊ������Ⱦ�� c��������ˮ�������ռ�NO
(2)д������������ˮ��Ӧ�Ļ�ѧ����ʽ_______�����б�������N�뱻��ԭ��N�����ʵ���֮��Ϊ__________��
(3)����������NO2�ļ�����ѧ��Ӧ��
��2NO+O2=2NO2 ��Fe+ 6HNO3(Ũ)= Fe (NO3)3 + 3NO2��+3H2O ��4HNO3![]() O2��+4NO2��+2H2O ��N2O4
O2��+4NO2��+2H2O ��N2O4![]() 2NO2
2NO2
��������NԪ�ػ�ԭ�Ե���_____ (���ţ���ͬ)������NԪ�������Ե���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϩ��A������ʽΪC8H16��A��һ�������±�����ֻ����һ������B�������������������A�м��֣�����˳���칹��
��֪��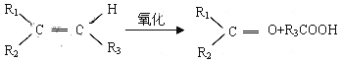
A. 3 B. 4 C. 6 D. 8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
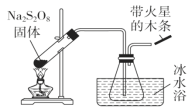
����Ŀ����������(Na2S2O8)���м�ǿ�������ԣ��Ҳ��ȶ���ij��ѧ��ȤС��̽���������Ƶ�������ʣ�ʵ�����¡���֪SO3����ɫ�ӷ��Ĺ��壬�۵�16.8�����е�44.8����
��1���ȶ���̽��(װ����ͼ)��
�ֽ�ԭ����2Na2S2O8![]() 2Na2SO4��2SO3����O2����
2Na2SO4��2SO3����O2����
��װ�������Դ���֮�����������______________________��ˮ�۱�ˮԡ��Ŀ����____________________�������ǵ�ľ��������_______________��
��2���������������Ի����£���Ag���Ĵ������¿���Mn2������Ϊ�Ϻ�ɫ�����ӣ�������Һ����BaCl2���Բ�����ɫ�������÷�Ӧ�����ӷ���ʽΪ______________________���÷�Ӧ����������______________������������________��
��3����������Һ�м���������BaCl2�����˺�Գ�������ϴ�ӵIJ�����___________________________��
��4������H2C2O4��Һ�ζ��������Ϻ�ɫ���ӣ�ȡ20mL����Һ������0.1mol��L��1��H2C2O4��Һ30mL����������Һ���Ϻ�ɫ���ӵ�Ũ��Ϊ______mol��L��1����Na2S2O8��ʣ�࣬���õ��Ϻ�ɫ����Ũ�Ƚ�________(����ƫ������ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�
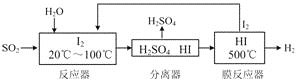
����˵����ȷ����
A. �����������ʷ���IJ���Ϊ����
B. �ù�����I2��HI���ת�������ˡ���ѭ����
C. ��Ӧ����Ĥ��Ӧ���зֱ����˷�������ԭ��Ӧ��������ԭ��Ӧ
D. ��ѭ�����յ��ܷ�ӦΪ2SO2 �� 4H2O �� I2 == H2+ 2H2SO4+ 2HI
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڿ����ϣ���ʦ��ʾ�˽�������![]() ��Һ��Ӧ��ʵ�飬ͬѧ�ǹ۲쵽�÷�Ӧ����������ɫ��
��Һ��Ӧ��ʵ�飬ͬѧ�ǹ۲쵽�÷�Ӧ����������ɫ��![]() ���������ݣ���û�з���ͭ���ʡ�ijͬѧ�룬�������Ϊ���ɵ�ͭ���ٶ�����ɫ���������ǴӶ�û�б������أ���������κ�ʵ���Ҽ���̽����ϣ����һ����ʵ������֤�Լ��IJ²��Ƿ���ȷ��
���������ݣ���û�з���ͭ���ʡ�ijͬѧ�룬�������Ϊ���ɵ�ͭ���ٶ�����ɫ���������ǴӶ�û�б������أ���������κ�ʵ���Ҽ���̽����ϣ����һ����ʵ������֤�Լ��IJ²��Ƿ���ȷ��
(1)�������Ǹ�ͬѧ������дһ��ʵ������������ʦ��Ҫ����ʦ�ṩ�������Ʒ��
��ʵ��̽����Ŀ�ģ�___________��
��̽�������ݵĻ�ѧԭ����_____________��
��ʵ��������������Ʒ��С��������Ƭ����ֽ��©����������������̨��____���ձ��� ҩƷ�������ơ�![]() ��Һ��______��
��Һ��______��
(2)��ͬѧ��̽��ʵ��������ط��������ɵ���ɫ�����л��������ĺ�ɫ���������ʹ�õ�ҩƷ��û�����⣬����Ϊ�ú�ɫ��������____________(�ѧʽ)�����ɸú�ɫ�������ԭ����(��ϻ�ѧ����ʽ�ͱ�Ҫ����������)____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г����¼ס��ҡ���������Һ����Ϊ0.1mol��L-1��NaOH��Һ����Ϊ0.1mol��L-1��HCl��Һ����Ϊ0.1mol��L-1��CH3COOH��Һ���Իش��������⣺
��1������Һ��pH=___��
��2������Һ�д��ڵĵ���ƽ��Ϊ___(�õ���ƽ�ⷽ��ʽ��ʾ)��
��3�������£���ˮϡ��0.1mol��L-1��CH3COOH��Һ�����и�����ˮ�������Ӷ��������___(�����)��
��n(H��) ��c(H��) ��![]() ��c(OH-)
��c(OH-)
��4���ס��ҡ���������Һ����ˮ�������c(OH-)������___��
��5��ijͬѧ�ü���Һ�ֱ�ζ�20.00mL����Һ��20.00mL����Һ���õ���ͼ��ʾ�������ζ����ߣ���a=___��
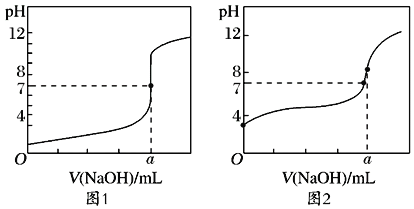
��6��ͼ___����1��2����ʾNaOH��Һ�ζ�CH3COOH��Һ�Ĺ��̡�
��7��ͼ2��a���Ӧ����ҺpH=8��ԭ����___�������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A(g)+3B(g) ![]() 2C(g)+D(g)�����ֲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ���٦�(A)=0.5mol��L-1��s-1���ڦ�(B)=0.6mol��L-1��s-1���ۦ�(C)=0.35mol��L-1��s-1���ܦ�(D)=0.3mol��L-1��min-1����÷�Ӧ�ڲ�ͬ�����·�Ӧ����������( )
2C(g)+D(g)�����ֲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ���٦�(A)=0.5mol��L-1��s-1���ڦ�(B)=0.6mol��L-1��s-1���ۦ�(C)=0.35mol��L-1��s-1���ܦ�(D)=0.3mol��L-1��min-1����÷�Ӧ�ڲ�ͬ�����·�Ӧ����������( )
A.��B.��C.��D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧԪ���γɵĵ��ʻ����ڹ�ũҵ���������¹�����ҽ�����������������Ҫ�����á�
��1�����������г��ù��������������ⶨ�����̵ĺ�������Ӧԭ��Ϊ��2Mn2++5S2O82��+8H2O![]() 2MnO4��+10SO42��+16H+
2MnO4��+10SO42��+16H+
�ٻ�̬Sԭ�Ӻ�����____�ֲ�ͬ�ռ��˶�״̬�ĵ��ӡ�
����֪H2S2O8�Ľṹ��ͼ��ʾ��

H2S2O8����ԭ�ӵĹ���ӻ���ʽΪ________��������Ӧÿ����1molMnO4����S2O82�����ѵĹ��ۼ����ͼ�����Ŀ�ֱ�Ϊ________��__________���谢��٤��������ֵΪNA��
��2��Fe������CN����H2NCONH2�����أ��ȶ��������γ�����
����д����CN����Ϊ�ȵ������һ�ַ��ӣ�______��һ�����ӣ�_________��
��������صĵڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ��________��1molH2NCONH2�����أ������к�����������ĿΪ_______��
��FeN�ľ�����ͼ1��ʾ��Cu������ȫ����þ�����aλ��Fe��bλ��Fe���γ�Cu����Ͳ���Fe(x��n)CunNy��

Cu�������ڱ���_____����������ܲ�ķ���Ϊ____����̬ͭԭ�ӵļ۵����Ų�ʽΪ________��FexNyת��Ϊ����Cu������Ͳ���������仯��ͼ2��ʾ��������Բ��ȶ���Cu����Ͳ���Ļ�ѧʽΪ_________��
��3����������ɫ�Ľᾧ�壬��Ӳ���࣬�����첻��֡����ٸֵ���Ҫԭ�ϡ�
��CrO2Cl2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ��ݴ˿��ж�CrO2Cl2��____�����������������Ǽ�����������
��CrCl3��6H2Oʵ������������λ����6���������������ɫ������һ��dz��ɫ������������������Ӧʱ��1mol���������1molAgCl������������dz��ɫ�����������ӵĻ�ѧʽΪ_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com