
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
【答案】16 sp3 σ键(或非极性键) 2.5NA CO C22- N>O>C 7NA ds N 3d104s1 FeCu3N 非极性 [Cr(H2O)4Cl2]+
【解析】
(1)①原子核外没有两个运动状态完全相同的电子,有几个电子就有几种运动状态,硫原子核外有16个电子,所以有16种不同运动状态的电子,故答案为:16。
②H2S2O8中,硫原子价层电子对数=σ键电子对+中心原子上的孤电子对=4+![]() (6-4×1-2)=4,所以采取sp3杂化;由方程式可知生成MnO4-时,S2O82-转化为SO42-,断掉中间的过氧键,即非极性键(或σ键),反应生成1molMnO4-,需要反应2.5NA的S2O82-,即断裂2.5NA的非极性键。故答案为:sp3杂化;σ键(或非极性键);2.5NA。
(6-4×1-2)=4,所以采取sp3杂化;由方程式可知生成MnO4-时,S2O82-转化为SO42-,断掉中间的过氧键,即非极性键(或σ键),反应生成1molMnO4-,需要反应2.5NA的S2O82-,即断裂2.5NA的非极性键。故答案为:sp3杂化;σ键(或非极性键);2.5NA。
(2)①价电子数与原子数都分别相等的粒子是等电子体,因此与CN-互为等电子体的一种分子和一种离子的化学式分别是CO和C22-,故答案为:CO、C22-。
②组成尿素的第二周期元素为N、C、O,同周期从左向右第一电离能增大,氮原子2p轨道半充满,为稳定状态,第一电离能大于O,因此第一电离能大小顺序是N>O>C;由尿素分子的结构式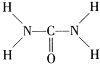 可知:1个C—N键中含有1个σ键,1个C=O键含有1个σ键,σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,故答案为:N>O>C,7NA。
可知:1个C—N键中含有1个σ键,1个C=O键含有1个σ键,σ键的数目为3,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,故答案为:N>O>C,7NA。
③Cu的价电子排布式为3d104s1,位于第四周期IB族,属于ds区;最高能层符号为N;Cu属于副族元素,价电子包括最外层电子,以及次外层的d能级,即基态铜原子的价电子排布式为3d104s1;能量低的晶胞稳定性强,即Cu替代a位置Fe型晶胞更稳定,每个晶胞均摊:Cu原子的个数为8×1/8=1,Fe位于面心,Fe原子的个数为6×1/2=3,N位于体心,N原子个数1,则Cu替代a位置Fe型化学式为Fe3CuN,故答案为:ds,N,3d104s1,FeCu3N。
(3)①CCl4、CS2都是非极性分子,非极性分子的溶质极易溶于非极性分子形成的溶剂,根据相似相溶原理知,CrO2Cl2是非极性分子,故答案为:非极性。
②1mol固体可生成1mol氯化银沉淀,说明该配合物的分子的外界有1个氯离子,则该配合物阳离子带1个单位的正电荷,其配位数是6,根据氯原子守恒知,则该配合物內界中含有2个氯原子和4个水分子,所以其阳离子为[Cr(H2O)4Cl2]+,故答案为:[Cr(H2O)4Cl2]+。


科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式 | |||
|
|
|
|
铁器在具有![]() 、_____等环境中容易被腐蚀。
、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.![]() 转化为
转化为![]() 。
。
Ⅱ.![]() 在自然环境中形成
在自然环境中形成![]() ,该物质中铁元素的化合价为_______。
,该物质中铁元素的化合价为_______。
Ⅲ.![]() 和
和![]() 反应形成致密的
反应形成致密的![]() 保护层,
保护层,![]() 的作用是_______。
的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.![]() 保护层被氧化为
保护层被氧化为![]() ,如此往复腐蚀,___
,如此往复腐蚀,___![]() +___
+___![]() +___
+___![]()
![]() ____
____![]() (将反应补充完整)
(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成![]() 保护层,法如下: 将铁器浸没在盛有
保护层,法如下: 将铁器浸没在盛有![]() 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用![]() 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:![]() 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较![]() 与
与![]() 溶解度的大小:__________较大。[填
溶解度的大小:__________较大。[填![]() 与
与![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
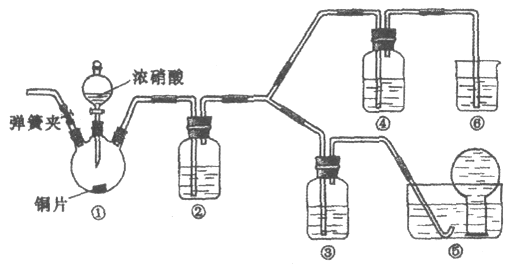
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应2NO2+2 NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是_____。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_______。
(3)装置①中发生反应的化学方程式是______。
(4)装置②的作用是_____,发生反应的化学方程式是______。
(5)该小组得出的结论所依据的实验现象是______。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确,这些方案中可行的是______。(选填字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
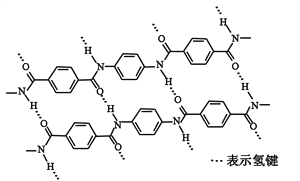
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
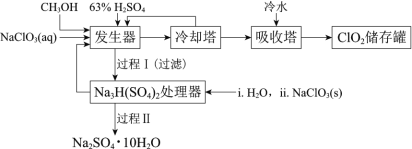
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH=12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2Ob.相关物质的熔沸点:
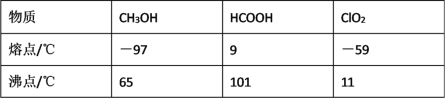
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有_____性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为 ______________(填字母)。
a.0~10℃ b.20~30℃ c.60~70℃
(3)可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如图:

① Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因 __(结合方程回答)。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,_______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和_____。
(4)为测定存储罐中所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇 匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
①准确量取10.00 mL ClO2溶液的玻璃仪器是______。
②若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_____ (填“偏高”、“偏低”或“无影响”)
③根据上述步骤可计算出原ClO2溶液的浓度为_____mol·L-1(用含字母的代数式表示)。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 molX气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() b Z(g)。反应达到平衡后,测得X的转化率为25%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的5/6,则a和b的数值可能是( )
b Z(g)。反应达到平衡后,测得X的转化率为25%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的5/6,则a和b的数值可能是( )
A.a=2,b=1 B. a=1,b=2 C.a=2,b=2 D. a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25 ℃时,对于含Fe2(SO4)3、FeSO4和CuSO4各0.5 mol的1 L混合溶液,根据上表数据判断,下列说法不正确的是( )
A. 在pH=5的溶液中,Fe3+不能大量存在
B. 混合溶液中c(SO![]() )∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
)∶[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5∶4
C. 向混合溶液中逐滴加入0.1 mol·L-1NaOH溶液,最先看到红褐色沉淀
D. 向混合溶液中加入适量氯水,并调节pH到3~4过滤,可获较纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
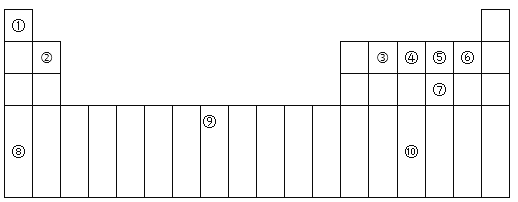
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com