
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
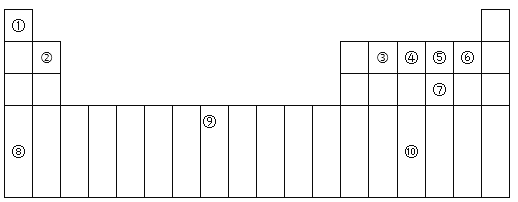
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
【答案】F 26 4s24p3 H2O H2O 离子 低
【解析】
根据元素在周期表中的位置可知,①为H元素,②为Be元素,③为C元素,④为N元素,⑤为O元素,⑥为F元素,⑦为S元素,⑧为K元素,⑨为Fe元素,⑩为As元素,结合元素周期表以及元素的性质进行答题。
(1)非金属性越强,电负性越大。在所给的元素中,氟元素的非金属性最强,则电负性最大的是氟元素,化学式为F,故答案为:F。
(2)由分析可知:⑨为Fe元素,铁元素的原子序数为26,原子核外有几个电子,其原子核外电子就有几种运动状态,所以Fe元素有26种运动状态不同的电子,故答案为:26。
(3)由分析可知:⑩为As元素,As为第四周期第ⅤA族元素,所以原子核外价电子排布式为4s24p3,故答案为:4s24p3。
(4)由分析可知:⑤为O元素、⑦为S元素,同一主族的元素,非金属性逐渐减弱,非金属性越强,形成的氢化物越稳定,非金属性:O>S,所以O和S元素形成的氢化物中较稳定的是H2O;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,但水中含有氢键,使得水的熔沸点变大,所以沸点较高的是H2O,故答案为:H2O,H2O。
(5)分析可知:⑦为S元素、⑧为K元素,由S元素和K元素形成的化合物为K2S,属于离子晶体,K2S和Na2O均属于离子化合物,离子电荷相同,离子半径K+>Na+,S2->O2-,Na2O的晶格能比K2S的大,所以K2S的熔点比Na2O的低,故答案为:低。


科目:高中化学 来源: 题型:
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解聚合物P的合成路线如下

(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是_____________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是___________。
(5)E→F中反应①和②的反应类型分别是___________。
(6)F的结构简式是_____________。
(7)聚合物P的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液导电能力越强,电导率越大。常温下用0.1000 mol/L盐酸分别滴定10.00 mL浓度均为0.1000 mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液{二甲胺在水中电离与氨相似,已知在常温下Kb[(CH3)2NH·H2O]=1.6×10-4},利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
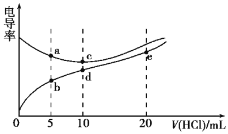
A.盐酸滴定二甲胺实验中选择酚酞作指示剂比选甲基橙误差更小
B.d点溶液中:c(H+)>c(OH-)+c[(CH3)2NH2+]
C.b、c、d、e四点的溶液中,水的电离程度最大的是d点
D.a点溶液与d点的溶液混合后的溶液中: c(OH-) < c(H+) < c[(CH3)2 NH2+] <c(Na+)< c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的硫酸亚铁和硫酸铁的溶液混合,再滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在![]() 的磁流体。下列说法中正确的是( )
的磁流体。下列说法中正确的是( )
A.该磁流体是一种纯净物B.所得的磁流体为悬浊液
C.该磁流体很不稳定D.所得的磁流体能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图其中能量最低的是___________(填字母),电子由状态B到状态C所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合__________________________。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为______________________________。与CN- 互为等电子体的化合物是______(写名称)。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素,其原子中未成对电子数为____。实验时形成的深蓝色溶液中的阳离子的结构简式为________。SO42-的立体构型为____,中心原子的杂化轨道类型为____。

(4)某种Al-Fe合金的晶胞如图所示,若合金的密度为ρg·cm-3,则晶胞中Al与Fe的最小距离为___ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 中的几种离子。
中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_____。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,原溶液中肯定有的离子是___。
(3)取(2)的滤液加入过量![]() ,出现白色沉淀,说明原溶液中肯定存在的离子有_____,离子反应方程式为____。
,出现白色沉淀,说明原溶液中肯定存在的离子有_____,离子反应方程式为____。
(4)原溶液中可能大量存在的阴离子是下列![]() 中的(填序号)_____。
中的(填序号)_____。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]A、B、C、D为原子序数依次增大的四种元素,A2-和B2+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的次外层电子排布式为 。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;B的氢化物所属的晶体类型是 ,B单质所形成的晶体,一个晶胞平均含有 个原子。
(3)C和D反应可生成组成比为1:5的化合物E,E的分子式为 ,已知该分子的空间构型为三角双锥,则其中两个Cl原子被F原子所替代得到的产物结构有 种。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与Na2SO3溶液反应,其离子方程式为 。
(5)A和B能够形成化合物F,F晶体中的B2+离子的排列方式如图所示,

①每个B2+周围最近的等距离的B2+离子有 个。
②已知F的晶胞参数是a0=0.54nm,它的密度为 (只列式不作计算,阿伏加德罗常数为6.02×1023mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法正确的是( )

A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com