
【题目】下表是元素周期表的一部分,有关说法正确的是( )

A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. 六种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
【答案】D
【解析】根据元素周期表,a、b、c、d、e、f依次为Na、Mg、C、O、S、Cl元素。A项,非金属性:O![]() S,d的氢化物比e的氢化物稳定,A项错误;B项,根据同周期从左到右原子半径逐渐减小,原子半径:a
S,d的氢化物比e的氢化物稳定,A项错误;B项,根据同周期从左到右原子半径逐渐减小,原子半径:a![]() b
b![]() e,B项错误;C项,c为C元素,C原子最外层有4个电子,既难失电子,又难得电子,c元素单质的化学性质不活泼,C项错误;D项,c、e、f的最高价氧化物对应的水化物依次为H2CO3、H2SO4、HClO4,H2CO3属于弱酸,H2SO4、HClO4都是强酸,非金属性:Cl
e,B项错误;C项,c为C元素,C原子最外层有4个电子,既难失电子,又难得电子,c元素单质的化学性质不活泼,C项错误;D项,c、e、f的最高价氧化物对应的水化物依次为H2CO3、H2SO4、HClO4,H2CO3属于弱酸,H2SO4、HClO4都是强酸,非金属性:Cl![]() S,酸性:HClO4
S,酸性:HClO4![]() H2SO4,c、e、f的最高价氧化物对应的水化物的酸性依次增强,D项正确;答案选D。
H2SO4,c、e、f的最高价氧化物对应的水化物的酸性依次增强,D项正确;答案选D。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量 SiO2)制备锑白的工艺流程如下图:
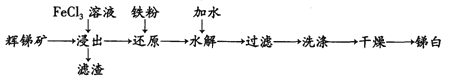
已知:
①Sb3+与Fe2+的氧化性强弱相当。
②Sb2S3不溶于水;Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
③水解时保持溶液的c(H+) =0.1~0.3mol/L。
(1) “浸出”是将辉锑矿溶于FeCl3溶液,为提高浸出速率可采取的措施是_________(任写一种)。请写出其中发生的氧化还原反应离子方程式: _________。滤渣的成分为S单质和_________。
(2) 水解是利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分为多步),其反应可以简单表示为:SbCl3 +3H2O![]() Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
Sb(OH)3 +3HCl,2Sb(OH)3 =Sb2O3 +3H2O。为了促进水解趋于完全,可采取的措施(填两点):_________。
(3) 简述检验沉淀是否洗净的实验方法: _________,若未出现浑浊则证明沉淀己洗干净,反之则没有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-1,3-丁二烯是一种重要的化工原料。可以发生以下反应。已知:
![]() 。
。
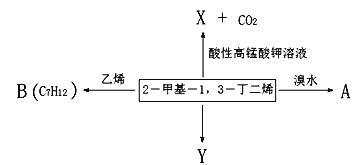
请回答下列问题:
(1)2-甲基-1,3-丁二烯与溴水发生加成反应。
①完全加成所得有机产物的名称____________;
②发生1,2-加成所得有机产物的结构简式为_______________________;
③发生1,4-加成反应的化学方程式为_______________________________________。
(2)B为含有六元环的有机物,写出2-甲基-1,3-丁二烯与乙烯反应的化学方程式______________。
(3)Y(![]() )是天然橡胶的主要成分。能发生的反应有_________(填标号)。
)是天然橡胶的主要成分。能发生的反应有_________(填标号)。
A.加成反应 B.氧化反应 C.消去反应 D.酯化反应
(4)X的分子式为C3H4O3,其结构简式为_________________;X与乙醇发生酯化反应的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑灰的主要成分是硫化钡(BaS),常用于制取氧化钡等钡盐。
I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62-)。
步骤5....
步骤6数据处理,计算黑灰中BaS含量。
(1)步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、_______。
(2)步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为____mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的BaS含量将会_______(填“偏高”、“偏低"或“不变”)。

(3)为保证实验结果的准确性,步骤5应为_______________。
II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(1)酸性矿井水(主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为_______________。
(2)查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水,________,根据采集的数据计算废水中SO42-含量。
(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/LBaCl2溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,书写不正确的是
A. 铁片放入稀硫酸溶液中:2Fe+6H+==2Fe3++3H2↑
B. 氢氧化镁与稀硫酸的反应:Mg(OH)2+2H+==Mg2++2H2O
C. Al(OH)3与盐酸的反应:Al(OH)3+3H+==Al3++3H2O
D. 铜与氯化铁溶液的反应:2Fe3++Cu==2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为![]() ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚
A. ①②③⑥ B. ①②④⑤ C. ①②⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.酯化反应也属于加成反应
B.酯化反应中羧酸脱去羧基中的羟基,醇脱去羟基中的氢原子生成水
C.浓硫酸在酯化反应中只起催化剂的作用
D.欲使酯化反应生成的酯分离并提纯,可以将酯蒸气通过导管伸入饱和碳酸钠溶液的液面下,再用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废料和废水的处理离不开化学。
I. 某工业废料含SiO2、FeS和CuS等物质,采用如下实验方案进行回收利用。请回答下列问题:
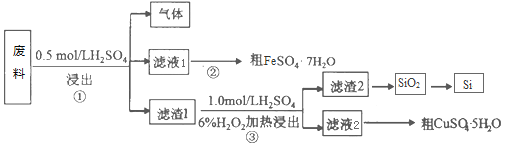
(1)已知步骤①中发生的化学反应为非氧化还原反应,写出产生气体的电子式_______,该气体可用足量的NaOH溶液吸收,该反应的离子方程式是_______________________________
(2)Si原子在周期表中的位置____________,写出晶体Si的一种主要用途___________。步骤②的操作依次为____________________、过滤、洗涤、干燥。滤渣2的主要成分是SiO2和S,写出步骤③涉及的化学方程式_________________________________。
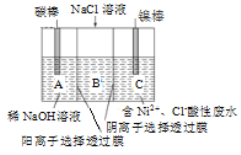
II.用一种阴、阳离子双隔膜三室电解槽处理含镍酸性废水并获得金属镍的模拟装置如图。
镍棒与外接电源____极相连。A极区电极反应式是__________________________。 电解一段时间后,B中NaCl溶液的浓度_________填“增大”、“减少”);若将图中阳离子膜去掉,将A、B两室合并,则A极区电极产物是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com