
【题目】铝、铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图其中能量最低的是___________(填字母),电子由状态B到状态C所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合__________________________。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为______________________________。与CN- 互为等电子体的化合物是______(写名称)。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素,其原子中未成对电子数为____。实验时形成的深蓝色溶液中的阳离子的结构简式为________。SO42-的立体构型为____,中心原子的杂化轨道类型为____。

(4)某种Al-Fe合金的晶胞如图所示,若合金的密度为ρg·cm-3,则晶胞中Al与Fe的最小距离为___ pm。
【答案】A 吸收 泡利原理 2[Fe(CN)6] 3++3Fe2+=Fe[Fe(CN)6]2↓ 一氧化碳 6 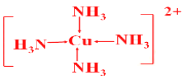 正四面体形 sp3杂化
正四面体形 sp3杂化 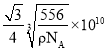
【解析】
(1)基态铝原子的电子排布式为1s22s22p63s23p1,因此能量最低的是选项A;电子由状态B到状态C需要吸收能量,所得原子光谱为吸收光谱,位于同一个轨道的2个电子自旋状态相反,根据状态D可知主要是不符合泡利原理。
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为2[Fe(CN)6]3++3Fe2+=Fe[Fe(CN)6]2↓。原子数和价电子数分别都相等的互为等电子体,与CN-互为等电子体的化合物是CO,名称是一氧化碳。
(3)与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素是Cr,其原子中未成对电子数为6。氨气和铜离子通过配位键形成阳离子,则实验时形成的深蓝色溶液中的阳离子的结构简式为 。SO42-中中心原子的价层电子对数是4且不含有孤对电子,其立体构型为正四面体形,中心原子的杂化轨道类型为sp3。
。SO42-中中心原子的价层电子对数是4且不含有孤对电子,其立体构型为正四面体形,中心原子的杂化轨道类型为sp3。
(4)根据晶胞结构可知晶胞含有4个Al和![]() 个Fe,若合金的密度为ρg·cm-3,则晶胞的边长是
个Fe,若合金的密度为ρg·cm-3,则晶胞的边长是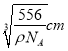 ,晶胞中Al与Fe的最小距离为体对角线的
,晶胞中Al与Fe的最小距离为体对角线的![]() ,即为
,即为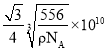 pm。
pm。


科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处;
(4)利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1 h的目的是_____。
(2)如何保证在70~80 ℃ 条件下进行滴定操作:_____。
(3)准确量取一定体积的KMnO4溶液用_____(填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用____(填序号)。
A.H2C2O4·2H2O B.FeSO4
C.浓盐酸 D.Na2SO3
(5)若准确称取Wg你选的基准试剂溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL:
①滴定终点标志是___;
②所配制KMnO4标准溶液的物质的量浓度为__ mol·L-1;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将___(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去)。

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中;
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2∶1.5)溶液;
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体;
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________;
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是_________;
(3)装置C用于尾气吸收,当尾气中n(NO2)∶n(NO)=1∶1时,过量的NaOH溶液能将NO,全部吸收,原因是_________(用化学方程式表示);
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是________;
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
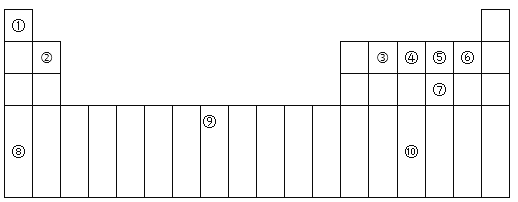
(1)在①~⑩元素的电负性最大的是:_____(填化学式)。
(2)⑨元素有____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布式为:_________。
(4)⑤的氢化物与⑦的氢化物比较稳定的是:___,沸点较高的是:____(填化学式)。
(5)元素⑦和⑧形成的化合物属于____晶体,它比Na2O的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答有关问题:
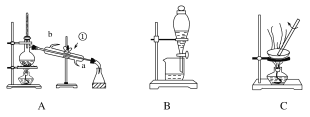
(1)装置A中玻璃仪器①的名称是________,进水的方向是从____口(填字母)进水。
(2)利用装置B分液时为使液体顺利滴下,应进行的具体操作是_________________。
(3)从氯化钾溶液中得到氯化钾固体,应选择装置________(填字母,下同);从碘水中分离出I2,应选择装置________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写:
(1) 我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按照一定比例混合而成的,爆炸时的化学反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。该反应中氧化剂是_____,还原剂是______,_____元素被氧化,每生成6.72LCO2(标准状况下)气体需要__g硫参加反应,并用双线桥法来表示电子转移的方向和数目:______。
(2)铁是人类较早使用的金属之一。
①鉴别![]() 胶体和
胶体和![]() 溶液的常用方法是_____,两者本质区别是_____ 。
溶液的常用方法是_____,两者本质区别是_____ 。
②电子工业中用![]() 溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜生产氯化亚铁和氯化铜,制造印刷电路板,请写出![]() 溶液与铜反应的离子方程式______。
溶液与铜反应的离子方程式______。
③![]() 胶体制备实验:
胶体制备实验:
实验步骤:取一个小烧杯,加入25mL蒸馏水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸。
实验现象:烧杯中溶液呈_____色;化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是异辛烷的球棍模型:

(1)根据球棍模型,写出异辛烷的结构简式:________;异辛烷与乙烷的关系是__________。
(2)写出异辛烷完全燃烧的化学方程式:______________________ (异辛烷用分子式表示)。1 mol异辛烷和1 mol正庚烷分别完全燃烧生成水和二氧化碳,消耗氧气的物质的量之差是___mol。
(3)异辛烷的同分异构体有很多,其中一种同分异构体X的分子结构中含有6个甲基,则X的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
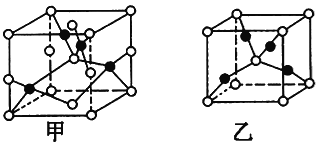
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号),其原因是___________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为_____,乙为______;高温时,甲易转化为乙的原因为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com