
【题目】以葡萄糖为原料制得的山梨酸醇(A)和异山梨酸醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。由葡萄糖为原料合成E的路线如下:

回答下列问题:
(1)葡萄糖的分子式为______;A中含有的官能团的名称为_______。
(2)C的结构简式为_______;由B到C的反应类型为____。
(3)由D到E的反应方程式为:_________。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),F的可能结构有_____种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为______。
【答案】C6H12O6 羟基 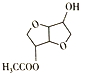 酯化反应
酯化反应 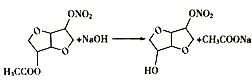 9
9 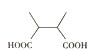
【解析】
葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,故A为![]() ,A在浓硫酸作用下发生分子内脱水反应生成B,B与乙酸发生酯化反应生成C,由分子式推知为酯化反应,根据C与D的分子式可知D是C分子中另一个羟基与硝酸发生酯化反应,D在NaOH溶液中发生水解反应,结合E的结构推知B中上方的-OH中-H被-NO2,下方-OH发生酯化反应,故C为
,A在浓硫酸作用下发生分子内脱水反应生成B,B与乙酸发生酯化反应生成C,由分子式推知为酯化反应,根据C与D的分子式可知D是C分子中另一个羟基与硝酸发生酯化反应,D在NaOH溶液中发生水解反应,结合E的结构推知B中上方的-OH中-H被-NO2,下方-OH发生酯化反应,故C为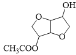 ,D为
,D为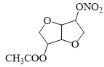 ,据此答题。
,据此答题。
(1)葡萄糖的分子式为C6H12O6;葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,因此A中含有的官能团的名称为羟基,故答案为:C6H12O6,羟基。
(2)根据B的结构简式可知C的结构简式为: ,由B到C的反应为酯化反应,故答案为:
,由B到C的反应为酯化反应,故答案为: ,酯化反应。
,酯化反应。
(3)由D到E的反应是乙酸形成的酯基水解,反应方程式为: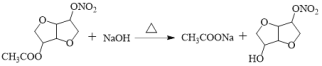 ,故答案为:
,故答案为:  。
。
(4)F是B的同分异构体。7.30g的F与足量饱和碳酸氢钠反应可释放出2.24LCO2(标准状况),说明F分子中含有羧基,7.30g的F的物质的量为7.30g÷146g/mol=0.05mol,二氧化碳的物质的量为0.1mol,因此F分子中含有2个羧基,则F相当于是丁烷分子中的两个氢原子被羧基取代,如果是正丁烷,根据定一移一可知有6种结构,如果是异丁烷,则有3种,所以可能有的结构有9种,即![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、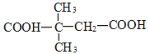 ,其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为
,其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构为 ,故答案为:9,
,故答案为:9,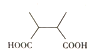 。
。


科目:高中化学 来源: 题型:
【题目】在课堂上,老师演示了金属钠与![]() 溶液反应的实验,同学们观察到该反应中生成了蓝色的
溶液反应的实验,同学们观察到该反应中生成了蓝色的![]() 沉淀和气泡,而没有发现铜单质。某同学想,会不会是因为生成的铜较少而被蓝色沉淀所覆盖从而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
沉淀和气泡,而没有发现铜单质。某同学想,会不会是因为生成的铜较少而被蓝色沉淀所覆盖从而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
(1)假如你是该同学,请你写一份实验准备单交给老师,要求老师提供必需的用品。
①实验探究的目的:___________。
②探究所依据的化学原理:_____________。
③实验必需的仪器或用品:小刀、玻璃片、滤纸、漏斗、玻璃棒、铁架台、____和烧杯; 药品:金属钠、![]() 溶液和______。
溶液和______。
(2)该同学在探究实验中意外地发现了生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________(填化学式),生成该黑色难溶物的原因是(结合化学方程式和必要的文字作答)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
①N2(g)+O2(g) 2NO(g) △H=+180 kJ/mol
②N2(g)+2O2(g) 2NO2(g) △H=+68 kJ/mol
则2NO(g)+O2(g) 2NO2(g) △H=_____kJ/mol
(2)对于反应2NO(g)+O2(g) 2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是_____
a.整个反应的速率由第一步反应速率决定
b.同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
c.第二步反应速率慢,因而平衡转化率也低
d.第二步反应的活化能比第一步反应的活化能高
(3)将氨气与二氧化碳在有催化剂的反应器中反应![]() △H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
△H=-87.0 kJ/mol,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
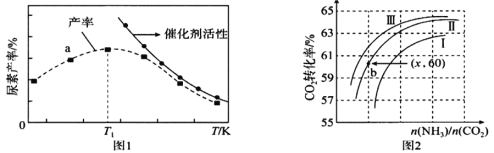
①a点_____(填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_____,测得b点氨的转化率为30%,则x=______________。
(4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2ON2H5++OH- K1=![]() ;N2H5++H2ON2H62++OH - K2=
;N2H5++H2ON2H62++OH - K2=![]() ;
;
①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学元素形成的单质或化合物在工农业生产、军事国防、医疗生活各个领域发挥着重要的作用。
(1)钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:2Mn2++5S2O82—+8H2O![]() 2MnO4—+10SO42—+16H+
2MnO4—+10SO42—+16H+
①基态S原子核外有____种不同空间运动状态的电子。
②已知H2S2O8的结构如图所示:

H2S2O8中硫原子的轨道杂化方式为________;上述反应每生成1molMnO4—,S2O82—断裂的共价键类型及其数目分别为________、__________(设阿伏伽德罗常数的值为NA)
(2)Fe可以与CN—、H2NCONH2(尿素)等多种配体形成配合物。
①请写出与CN—互为等电子体的一种分子:______、一种离子:_________。
②组成尿素的第二周期元素的第一电离能由大到小的顺序为:________,1molH2NCONH2(尿素)分子中含有σ键的数目为_______。
③FeN的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x—n)CunNy。

Cu处于周期表中_____区,其最高能层的符号为____,基态铜原子的价电子排布式为________。FexNy转化为两种Cu的替代型产物的能量变化如图2所示,其中相对不稳定的Cu替代型产物的化学式为_________。
(3)铬是银灰色的结晶体,质硬而脆,是制造不锈钢、高速钢的重要原料。
①CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是____(填“极性”或“非极性”)分子
②CrCl3·6H2O实际上是配合物,配位数是6,其固体有三种颜色,其中一种浅绿色固体于足量硝酸银反应时,1mol固体可生成1molAgCl沉淀,则这种浅绿色固体中阳离子的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某体积不变的密闭容器进行的可逆反应:3A(s) ![]() 2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
2B(g)+C(g),下列各关系中能说明反应已达到平衡状态的是( )
A.生成 B和C的速率比为2:1B.生成2n molB同时生成n molC
C.混合气体的密度不变D.混合气体的平均相对分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是甲醇燃料电池的结构示意图。电池总反应为:2CH3OH+3O2→2CO2+4H2O。下列说法正确的是( )

A. 左电极为电池的负极,a处通入的物质是空气
B. 右电极为电池的负极,b处通入的物质是甲醇
C. 负极反应式为:CH3OH+H2O-6e-= CO2+6H+
D. 正极反应式为:O2+2H2O -4e-= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,正反应方向是放热反应 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图其中能量最低的是___________(填字母),电子由状态B到状态C所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合__________________________。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)K3[Fe(CN)6]溶液可用于检验Fe2+,生成沉淀的离子方程式为______________________________。与CN- 互为等电子体的化合物是______(写名称)。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中,最外层电子数与铜原子相同的元素,其原子中未成对电子数为____。实验时形成的深蓝色溶液中的阳离子的结构简式为________。SO42-的立体构型为____,中心原子的杂化轨道类型为____。

(4)某种Al-Fe合金的晶胞如图所示,若合金的密度为ρg·cm-3,则晶胞中Al与Fe的最小距离为___ pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com