
【题目】氮及其化合物之间可以相互转化,请按照要求回答下列问题:
(1)下列有关NO和NO2的描述正确的是__________(填标号)。
a.均为无色气体 b.均为大气污染物 c.可用排水集气法收集NO
(2)写出二氧化氮与水反应的化学方程式_______,其中被氧化的N与被还原的N的物质的量之比为__________。
(3)如下是生成NO2的几个化学反应:
①2NO+O2=2NO2 ②Fe+ 6HNO3(浓)= Fe (NO3)3 + 3NO2↑+3H2O ③4HNO3![]() O2↑+4NO2↑+2H2O ④N2O4
O2↑+4NO2↑+2H2O ④N2O4![]() 2NO2
2NO2
其中体现N元素还原性的是_____ (填标号,下同),体现N元素氧化性的是_____。
【答案】bc 3NO2+H2O=2HNO3+NO 2:1 ① ②③
【解析】
(1) NO和NO2均为大气污染物,NO为无色气体,难溶于水,可用排水法收集,NO2为红棕色气体,易溶于水,不可用排水法收集,所以正确的有bc ;
(2)二氧化氮与水反应生成硝酸和水,化学方程式为3NO2+H2O=2HNO3+NO,二氧化氮中氮为+4价,产物硝酸中氮为+5价,一氧化氮中氮为+2价,所以化合价升高、被氧化的氮原子有2个,化合价降低、被还原的氮原子有1个,即被氧化的N与被还原的N的物质的量之比为2:1;
(3) ①2NO+O2=2NO2氮元素化合价升高 ②Fe+ 6HNO3(浓)= Fe (NO3)3+ 3NO2↑+3H2O氮元素化合价降低 ③4HNO3![]() O2↑+4NO2↑+2H2O氮元素化合价降低 ④N2O4
O2↑+4NO2↑+2H2O氮元素化合价降低 ④N2O4![]() 2NO2 氮元素化合价不变,化合价升高体现还原性,化合价降低体现氧化性,则体现N元素还原性的是①,体现N元素氧化性的是②③。
2NO2 氮元素化合价不变,化合价升高体现还原性,化合价降低体现氧化性,则体现N元素还原性的是①,体现N元素氧化性的是②③。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁是黄色晶体,常用作照相显影剂、新型电池材料等。
实验室制备草酸亚铁并测定其中Fe2+和C2O42的物质的量之比确定其纯度,步骤如下:
Ⅰ.称取一定质量的硫酸亚铁铵[(NH4)2Fe(SO4)2]于烧杯中,加蒸馏水和稀硫酸,加热溶解,再加饱和H2C2O4溶液,加热沸腾数分钟,冷却、过滤、洗涤、晾干,得黄色晶体。
Ⅱ.称取m gⅠ中制得的晶体于锥形瓶中,加入过量稀硫酸使其溶解,70℃水浴加热,用c mol·L1 KMnO4溶液滴定至终点,消耗KMnO4溶液v1 mL(其中所含杂质与KMnO4不反应)。
Ⅲ.向Ⅱ滴定后的溶液中加入过量锌粉和稀硫酸,煮沸,至反应完全,过滤,用c mol·L1 KMnO4溶液滴定滤液至终点,消耗KMnO4溶液v2 mL。
Ⅳ.重复上述实验3次,计算。
已知:ⅰ.草酸是弱酸。
ⅱ.pH>4时,Fe2+易被O2氧化。
ⅲ.酸性条件下,KMnO4溶液的还原产物为近乎无色的Mn2+。
回答下列问题:
(1)Ⅰ中加入稀硫酸的目的是__________________________、_______________________。
(2)Ⅱ中与KMnO4溶液反应的微粒是_____________、____________。
(3)Ⅲ中加入过量锌粉仅将Fe3+完全还原为Fe2+。若未除净过量锌粉,则消耗KMnO4溶液的体积V ______v2 mL(填“>”、“=”或“<”)。
(4)Ⅲ中,滴定时反应的离子方程式是__________________________,滴定时KMnO4溶液装在__________________(玻璃仪器)中,滴定终点的现象_________________________________________。
(5)m gⅠ中制得的晶体中,Fe2+和C2O42的物质的量之比是____________________(用含v1、 v2的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
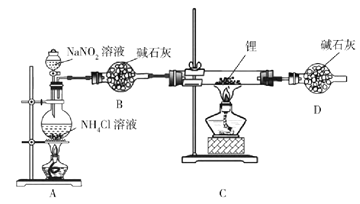
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
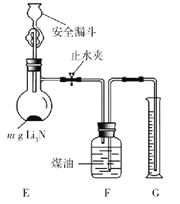
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲胺[(CH3)2NH]在水中电离与氨相似,![]() 。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
。常温下,用0. l00mol/L的HCl分别滴定20. 00mL浓度均为0.l00mol/L的NaOH和二甲胺溶液,测得滴定过程中溶液的电导率变化曲线如图所示。下列说法正确的是
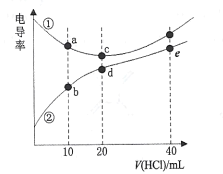
A.b点溶液:![]()
B.d点溶液:![]()
C.e点溶液中:![]()
D.a、b 、c、d点对应的溶液中,水的电离程度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体电解质可以通过离子迁移传递电荷,利用固体电解质RbAg4I5可以制成电化学气敏传感器,其中迁移的物种全是Ag+。下图是一种测定O2含量的气体传感器示意图,O2可以透过聚四氟乙烯薄膜,根据电池电动势变化可以测得O2的含量。在气体传感器工作过程中,下列有关说法正确的是
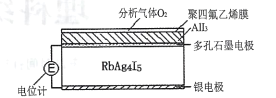
A.银电极被消耗,RbAg4I5的量增多
B.电位计读数越大,O2含量越高
C.负极反应为Ag+I--e-= AgI
D.部分A1I3同体变为Al和AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeS溶于盐酸中,生成FeCl2和H2S气体。现将100mL2.0mol/L的盐酸加入到一定量的FeS固体中,以制备H2S气体。当盐酸完全反应后假定溶液体积不变。
试计算:(1)可收集到的H2S气体在标准状况下的体积___________________;
(2)反应后溶液中FeCl2的物质的量浓度_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于①放热反应 ②吸热反应
A:分解反应 B:化合反应C:置换反应
(1)氯酸钾分解制氧气,既是_______(填①或②)又是______。(填A或B或C,下同)
(2)生石灰跟水反应生成熟石灰,既是_______又是______。
(3)锌粒与稀硫酸的反应,既是_______又是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
① 高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于_______(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
② 高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是_______(填字母)。
a.铜 b.石墨 c.二氧化硅
③ 高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和_________(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养平衡、合理用药是保证人体健康和生活质量的重要途径。
① 在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是____。(填元素符号)
② 下列物质中,具有抗菌消炎疗效的是____(填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③ 如图为某品牌鸡精标签的一部分,其中能水解生成氨基酸的配料是_____,属于着色剂的是_____,属于防腐剂的是_____。

(3)为了减轻我市的雾霾状况,《苏州市市区禁止燃放烟花爆竹规定》明确规定,自2017年1月1日起,姑苏区全区,苏州工业园区、高新区、吴中区、相城区、吴江区各区部分区域禁止燃放烟花爆竹。
① 燃煤是形成雾霾天气的罪魁祸首之一。向煤中加入一定量的石灰石进行“____”处理,可以减少SO2的排放。该反应的化学方程式为_____________________。
② 汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为____________。
③ 含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,制定的方案是先用(NH4)2Fe(SO4)2将Cr2O![]() 转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
转化为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该过程中的氧化剂为______;该方案处理后的废水中因含有大量______(填离子符号),会导致水体富营养化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用,某博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
主要成分的化学式 | |||
|
|
|
|
铁器在具有![]() 、_____等环境中容易被腐蚀。
、_____等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.![]() 转化为
转化为![]() 。
。
Ⅱ.![]() 在自然环境中形成
在自然环境中形成![]() ,该物质中铁元素的化合价为_______。
,该物质中铁元素的化合价为_______。
Ⅲ.![]() 和
和![]() 反应形成致密的
反应形成致密的![]() 保护层,
保护层,![]() 的作用是_______。
的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.![]() 保护层被氧化为
保护层被氧化为![]() ,如此往复腐蚀,___
,如此往复腐蚀,___![]() +___
+___![]() +___
+___![]()
![]() ____
____![]() (将反应补充完整)
(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成![]() 保护层,法如下: 将铁器浸没在盛有
保护层,法如下: 将铁器浸没在盛有![]() 溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用
溶液的容器中,缓慢加热至 60~90℃。一段时间, 取出器物,用![]() 溶液洗涤至无Cl-。
溶液洗涤至无Cl-。
①检测洗涤液中 Cl-的方法是_____。
②脱氯反应:![]() 。离子反应的本质是离子浓度的减小,比较
。离子反应的本质是离子浓度的减小,比较![]() 与
与![]() 溶解度的大小:__________较大。[填
溶解度的大小:__________较大。[填![]() 与
与![]() ]
]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com