
����Ŀ���������ʿ���ͨ������Ǩ�ƴ��ݵ�ɣ����ù�������RbAg4I5�����Ƴɵ绯ѧ����������������Ǩ�Ƶ�����ȫ��Ag+����ͼ��һ�ֲⶨO2���������崫����ʾ��ͼ��O2���������ķ���ϩ��Ĥ�����ݵ�ص綯�Ʊ仯���Բ��O2�ĺ����������崫�������������У������й�˵����ȷ����
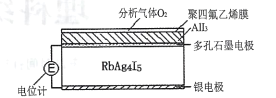
A.���缫�����ģ�RbAg4I5��������
B.��λ�ƶ���Խ��O2����Խ��
C.������ӦΪAg+I--e-= AgI
D.����A1I3ͬ���ΪAl��AgI
���𰸡�B
��������
O2ͨ�������Ӧ��4AlI3+3O2=2Al2O3+6I2��I2�ڴ���������з�����ԭ��Ӧ����˶��ʯī�缫Ϊ�������缫��ӦʽΪ��I2+2Ag++2e-=2AgI�����缫����������Ӧ��������������������RbAg4I5��Ǩ�Ƶ�������Ag+���缫��ӦʽΪ��Ag-e-=Ag+���ݴ˽��
A��������������֪�����������������У����缫�����ģ����������ܷ�ӦΪ��I2+2Ag=2AgI�����������RbAg4I5��Ǩ�Ƶ�������Ag+�����RbAg4I5�������ᷢ���仯����A����
B��O2����Խ�ߣ���λʱ����ת�Ƶ�����Խ�࣬��λ�ƶ���Խ��B��ȷ��
C��������������֪��������ӦΪ��Ag-e-=Ag+����C����
D��������������֪������AlI3����Al2O3��I2����D����
�ʴ�Ϊ��B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2��2H2O��I2===H2SO4��2HI
�� 2HI![]() H2��I2
H2��I2
�� 2H2SO4===2SO2��O2��2H2O
��1������������Ӧ�������ж���ȷ����____________��
a����Ӧ�����ڳ����½��� b����Ӧ����SO2�����Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�����̲���1 mol O2��ͬʱ����1 mol H2
��2��һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��

0��2 min�ڵ�ƽ����Ӧ����v(HI)��____________�����¶��£�H2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K��____________��
2HI(g)��ƽ�ⳣ��K��____________��
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��____________�ƶ�(����������ҡ�����)�����������������Լ��е�____________������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��4����H2Ϊȼ�Ͽ���������ȼ�ϵ�ء�
��֪2H2(g)��O2(g)===2H2O(l) ��H����572 kJ��mol��1
ij����ȼ�ϵ���ͷ�228.8 kJ����ʱ������1 molҺ̬ˮ���õ�ص�����ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���ж�������������0.05%�����������ʱ�辭����������ŷš�ijУ��ȤС�����ⶨ���Ṥҵβ���ж������������������·�����
��������ͼ��ʾ��ͼ������������B����ȷ����ͨ��β�����������β��ͨ��һ�������֪Ũ�ȵĵ�ˮ�вⶨ��������ĺ�����
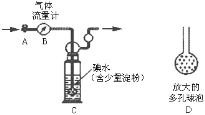
��1��ϴ��ƿC�е���ĩ������һ���������D���������ʵ��ȷ�ȣ��������ǣ�_________��
��2��ϴ��ƿC�е���Һ�������Ը��������Һ�������д�����ӷ���ʽ��________��
��3����ʵ��Ĺؼ����ڹر����������Ƶ�ʱ����Ӧ����ʲôʱ��رջ���A____________
�ҷ�����ʵ�鲽������������ͼ��ʾ��
![]()
��4��д��������з�Ӧ�Ļ�ѧ����ʽ_________��
��5������жϲ�����г����Ƿ���ȫ�ķ���___________��
��6�����ⶨ��ͨ����β�����Ϊ67.2L���ѻ���ɱ�״����ʱ�����յõ���������Ϊ4.66g�����β���ж��������������������Ϊ__________��������0.01%��
�������������в����ʡ�ԣ�ֱ�ӽ�β��ͨ�����Ba(OH)2��Һ�����ಽ���뷽������ͬ��
��7������Ϊ������________�����ǻ������˵�����ɣ�___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��Radialene����һ����صĻ�״ϩ�����价��ÿһ��̼ԭ�Ӷ�����һ��˫������nԪ������ϩ���Ա�ʾΪ[ n]��ϩ������ͼ�����ּ���ϩ�������й�˵������ȷ����
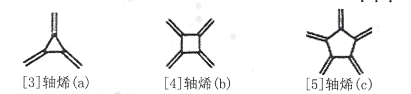
A.a����������ԭ�Ӷ���ͬһ��ƽ����B.b��ʹ����KMnO4��Һ��ɫ
C.c�� ��Ϊͬ���칹��D.��ϩ��ͨʽ�ɱ�ʾΪC2nH2n��n��3��
��Ϊͬ���칹��D.��ϩ��ͨʽ�ɱ�ʾΪC2nH2n��n��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A.�Ȼ�����Һ�м��������ˮ��Al3++4OH��=![]() +2H2O
+2H2O
B.����������Һ��ϡ���ᷴӦ��Ba2+��![]() =BaSO4��
=BaSO4��
C.̼��������ᷴӦ��![]() +2H��=H2O+CO2��
+2H��=H2O+CO2��
D.��������ˮ��Ӧ��2Na+2H2O=2Na��+2OH����H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����֮������ת�����밴��Ҫ��ش��������⣺
(1)�����й�NO��NO2��������ȷ����__________(����)��
a����Ϊ��ɫ���� b����Ϊ������Ⱦ�� c��������ˮ�������ռ�NO
(2)д������������ˮ��Ӧ�Ļ�ѧ����ʽ_______�����б�������N�뱻��ԭ��N�����ʵ���֮��Ϊ__________��
(3)����������NO2�ļ�����ѧ��Ӧ��
��2NO+O2=2NO2 ��Fe+ 6HNO3(Ũ)= Fe (NO3)3 + 3NO2��+3H2O ��4HNO3![]() O2��+4NO2��+2H2O ��N2O4
O2��+4NO2��+2H2O ��N2O4![]() 2NO2
2NO2
��������NԪ�ػ�ԭ�Ե���_____ (���ţ���ͬ)������NԪ�������Ե���_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������Һ�к��д�����Cu2+ ��Fe3+��Fe2+ ��![]() ��ij��ȤС����������·������Է�Һ�����ۺ����û����Cu���̷�(FeSO4��7H2O)��
��ij��ȤС����������·������Է�Һ�����ۺ����û����Cu���̷�(FeSO4��7H2O)��

��ش��������⣺
(1)����1�Ͳ���2��������________��
(2)��Һ�мӹ�����ʱ������Ӧ�����ӷ���ʽΪ_______________��________________��
(3)�ϲ���Һ1����Һ2��ϵ�в���3����__________��____________�����˵Ȳ�����
(4)��ʹ�õõ����̷������Ʊ���ˮ��Fe2(SO4)3��Һ�������̷��м�������ϡ�����⣬����Ҫ����____(����)��
��ϡH2SO4 ��Cl2 ��H2O2 ��Fe��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���ô�ĥ������Ƭ��������ʵ�飬���з�������������( )
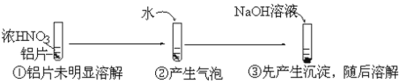
A.������Ƭ�����˶ۻ�
B.���в����������ǵ����������������
C.���г����ܽ�����ӷ���ʽ��![]()
D.���м�ˮϡ�����У���������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ�����ղ���������SO2���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�
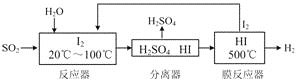
����˵����ȷ����
A. �����������ʷ���IJ���Ϊ����
B. �ù�����I2��HI���ת�������ˡ���ѭ����
C. ��Ӧ����Ĥ��Ӧ���зֱ����˷�������ԭ��Ӧ��������ԭ��Ӧ
D. ��ѭ�����յ��ܷ�ӦΪ2SO2 �� 4H2O �� I2 == H2+ 2H2SO4+ 2HI
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com