
【题目】氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应。某小组设计实验制备氮化锂并测定其纯度,装置如图所示:
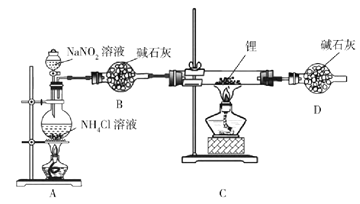
实验室用NH4Cl溶液和NaNO2溶液共热制备N2。
(1)盛装NH4Cl溶液的仪器名称是___________。
(2)安全漏斗中“安全”含义是__________。实验室将锂保存在_____(填“煤油”“石蜡油”或“水”)中。
(3)写出制备N2的化学方程式__________。
(4)D装置的作用是____________。
(5)测定Li3N产品纯度:取mg Li3N产品按如图所示装置实验。
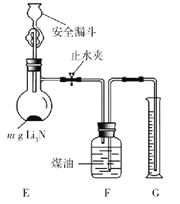
打开止水夹,向安全漏斗中加入足量水,当Li3N完全反应后,调平F和G中液面,测得NH3体积为VL(已折合成标准状况)。
①读数前调平F和G中液面的目的是使收集NH3的大气压________(填“大于”“小于”或“等于”)外界大气压。
②该Li3N产品的纯度为________%(只列出含m和V的计算式,不必计算化简)。若 Li3N产品混有Li,则测得纯度_____________(选填“偏高”“偏低”或“无影响”)。
【答案】圆底烧瓶 残留在漏斗颈部的液体起液封作用;当内部气体多、压强大时,又可通过积留液体而放出气体 石蜡油 NaNO2+NH4Cl![]() NaCl+N2↑+2H2O 防止空气中的水蒸气和二氧化碳进入,干扰试验 等于
NaCl+N2↑+2H2O 防止空气中的水蒸气和二氧化碳进入,干扰试验 等于 ![]() 偏高
偏高
【解析】
分析题给装置图,可知装置A为NH4Cl溶液和NaNO2溶液共热制备N2的发生装置,装置B的目的为干燥N2,装置C为N2和金属Li进行合成的发生装置,装置D的主要目的是防止空气中的水蒸气和二氧化碳进入,干扰试验。据此解答。
(1)盛装NH4Cl溶液的仪器是圆底烧瓶,答案为:圆底烧瓶;
(2)安全漏斗颈部呈弹簧状,残留液体起液封作用,当内部气体多、压强大时,又可通过积留液体而放出气体;锂的密度小于煤油,锂与水反应,常将锂保存在石蜡油中。答案为:残留在漏斗颈部的液体起液封作用,当内部气体多、压强大时,又可通过积留液体而放出气体;石蜡油
(3)亚硝酸钠与氯化铵共热生成氮气、氯化钠和水。反应方程式为:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O。答案为:NaNO2+NH4Cl
NaCl+N2↑+2H2O。答案为:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)锂能与二氧化碳、水反应,氮化锂能与水反应,故用D装置吸收空气中的水蒸气和二氧化碳。答案为:防止空气中的水蒸气和二氧化碳进入,干扰试验;
(5)①氨气压强无法直接测定,只能测定外界大气压,当G和F中液面相平时,氨气压强等于外界大气压。答案为:等于;
②装置E中发生反应:Li3N+3H2O=3LiOH+NH3↑,根据题意有:n(NH3)=![]() mol,则ω(Li3N)=
mol,则ω(Li3N)=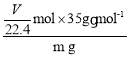 ×100%=
×100%=![]() %。锂能与水反应产生H2,如果产品混有锂,则产生气体体积偏大,测得产品纯度偏高;答案为:
%。锂能与水反应产生H2,如果产品混有锂,则产生气体体积偏大,测得产品纯度偏高;答案为:![]() ;偏高。
;偏高。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(H2NCH2COO)2Fe]是一种新型补铁剂。某化学学习小组用如图所示装置(夹持仪器省略)制备甘氨酸亚铁。
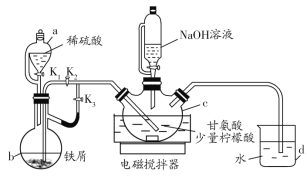
有关物质性质如下表所示:
甘氨酸(H2NCH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸仲溶解度大于在乙醇中的溶解度。 |
柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸。 |
实验步骤如下:
Ⅰ.打开K1、K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是__,d的作用是__。
(2)步骤Ⅰ中将b中溶液加入到c中的操作是__;步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质___(写化学式)。
(3)c中生成甘氨酸亚铁的化学方程式是__。
(4)下列关于该实验的说法错误的是__(填写序号)。
a.步骤Ⅰ中可由d中导管冒出气泡的快慢来判断装置中的空气是否排尽
b.反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
c.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)工业上常用高氯酸在非水体系中滴定甘氨酸的方法测定产品中的甘氨酸的含量。请设计实验,将所得粗产品中的甘氨酸分离出来直接用于滴定:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是()
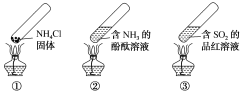
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
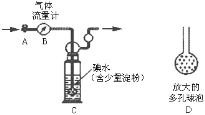
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:_________。
(2)洗气瓶C中的溶液可以酸性高锰酸钾溶液替代,请写出离子方程式:________。
(3)本实验的关键在于关闭气体流量计的时机,应当在什么时候关闭活塞A____________
乙方案:实验步骤如以下流程图所示:
![]()
(4)写出步骤①中反应的化学方程式_________。
(5)如何判断步骤②中沉淀是否完全的方法___________。
(6)经测定当通过的尾气体积为67.2L(已换算成标准状况)时,最终得到固体质量为4.66g,则该尾气中二氧化硫含量(体积分数)为__________(保留到0.01%)
丙方案:将乙中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案________(填是或否)合理,说明理由:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A. ①②③B. ①③④C. ①③D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轴烯(Radialene)是一类独特的环状烯烃,其环上每一个碳原子都接有一个双键,含n元环的轴烯可以表示为[ n]轴烯,如下图是三种简单的轴烯。下列有关说法不正确的是
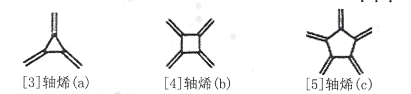
A.a分子中所有原子都在同一个平面上B.b能使酸性KMnO4溶液褪色
C.c与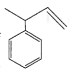 互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
互为同分异构体D.轴烯的通式可表示为C2nH2n(n≥3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物之间可以相互转化,请按照要求回答下列问题:
(1)下列有关NO和NO2的描述正确的是__________(填标号)。
a.均为无色气体 b.均为大气污染物 c.可用排水集气法收集NO
(2)写出二氧化氮与水反应的化学方程式_______,其中被氧化的N与被还原的N的物质的量之比为__________。
(3)如下是生成NO2的几个化学反应:
①2NO+O2=2NO2 ②Fe+ 6HNO3(浓)= Fe (NO3)3 + 3NO2↑+3H2O ③4HNO3![]() O2↑+4NO2↑+2H2O ④N2O4
O2↑+4NO2↑+2H2O ④N2O4![]() 2NO2
2NO2
其中体现N元素还原性的是_____ (填标号,下同),体现N元素氧化性的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: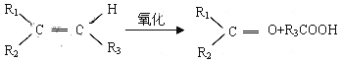
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com