
����Ŀ��������Ԫ�����ڱ��Ľṹ���û�ѧ��������������⡣
�� | |||||||||||||||||
�� | �� | �� | |||||||||||||||
�� | �� | �� | �� | �� | |||||||||||||
��1�������б�ŵ�Ԫ���л�ѧ��������õģ���ԭ�ӽṹʾ��ͼΪ__������ݰ���ԭ�Ӹ�����1��1�γɵĻ������к��еĻ�ѧ����___��
��2��������γɵ��������Ŀռ乹��Ϊ__�����˻��������ĵ��ʻ����һ����ļ���ƿ���ܷ����ڹ�����һ��ʱ��۲쵽��������__��
��3���ɢ��γɵĵ��ʵĵ���ʽΪ__������ߵ���ͼ��γɵĻ�����ĵ���ʽΪ__��
��4���������������Ӧ��ˮ����Ļ�ѧʽ��___���ٷֱ���ܡ����γɵļ�������ȶ�����ǿ������˳����__��
��5���ܡ��ޡ�������Ԫ�ص�ԭ���γɵļ������а뾶�ɴ�С��˳����__��
��6�����������յĻ�ѧ���ۣ����һ��ʵ�飬֤���ߵķǽ����ԱȢ�ǿ__���û�ѧ����ʽ��ʾ����Ӧԭ������
���𰸡�![]() ���Ӽ����Ǽ��Թ��ۼ� �������� ������ɫ��dz��������������״Һ��
���Ӽ����Ǽ��Թ��ۼ� �������� ������ɫ��dz��������������״Һ�� ![]()
![]() HClO4 H2O>H2S Cl->O2->Al3+ H2SO4+Na2CO3=Na2SO4+CO2��+H2O
HClO4 H2O>H2S Cl->O2->Al3+ H2SO4+Na2CO3=Na2SO4+CO2��+H2O
��������
��Ԫ�����ڱ���֪�٢ڢۢܢݢޢߢ��ֱ�Ϊ��H��C��N��O��Na��Al��S��Cl��Ar���ݴ˽��
(1).��ѧ��������õ�Ԫ��Ϊϡ�����壬��Ar������ݰ���ԭ�Ӹ�����1��1�γɵĻ�������ΪNa2O2���������Ӽ��ͷǼ��Թ��ۼ����ʴ�Ϊ��![]() �����Ӽ��ͷǼ��Թ��ۼ���
�����Ӽ��ͷǼ��Թ��ۼ���
(2).������γɵ��������ΪCH4���ռ乹��Ϊ�������壬���˻��������ĵ���Cl2�����һ����ļ���ƿ���ܷ����ڹ�����������Ӧ����һ�ȼ��顢���ȼ��顢���ȼ��顢���Ȼ�̼���Ȼ��⣬�ʴ�Ϊ���������壻������ɫ��dz��������������״Һ�Σ�
(3).�ɢ��γɵĵ�����N2�������ʽΪ![]() ������ߵ���ͼ��γɵĻ�����ΪNa2S�������ʽΪ
������ߵ���ͼ��γɵĻ�����ΪNa2S�������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(4).������Ϊ+7�ۣ�������������Ӧ��ˮ����Ļ�ѧʽ��HClO4���ܡ��߷ֱ�Ϊ��O��S��O�ķǽ����Ա�Sǿ�����γɵļ�������ȶ�����ǿ������˳����H2O>H2S���ʴ�Ϊ��HClO4��H2O>H2S��
(5).�ܡ��ޡ�������Ԫ�ص�ԭ���γɵļ����ӷֱ�Ϊ��O2-��Al3+��Cl-���Ƚ����Ӱ뾶���ȿ����Ӳ�����Cl-�����㣬��O2-��Al3+��Ϊ���㣬�����Ӳ�ṹ��ͬʱ��ԭ������С�İ뾶����뾶�ɴ�С��˳����Cl->O2->Al3+���ʴ�Ϊ��Cl->O2->Al3+��
(6).��ʵ��ķ�ʽ֤���ǽ�����ǿ������ѡ��ǿ������ԭ����������ѡ��������ȡ̼�ᣬ�ʴ�Ϊ��H2SO4+Na2CO3=Na2SO4+CO2��+H2O��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��R��P��Q�Ƕ���������Ԫ�أ�������Ϣ���±���ʾ��
X | Y | Z | W | R | P | Q | |
ԭ�Ӱ뾶/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
��Ҫ���ϼ� | -4��+4 | -2 | -1��+7 | -3��+5 | +3 | ||
���� | �����Ӻ������� | ���ǽ������ϵ����� | ��ɫ��Ӧ�ʻ�ɫ |
��1��R����Ȼ������������Ϊ35��37�����ֺ��أ�����֮��Ĺ�ϵ�ǻ�Ϊ___��
��2��Z�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ��___��R��Q��Ԫ�����������ˮ���ﷴӦ�����ӷ���ʽ___��
��3��Y��R��ȣ��ǽ����Խ�ǿ����___����Ԫ�ط��ű�ʾ����������ʵ��֤����һ���۵���___������ĸ��ţ���
a.������Y�ĵ��ʳʹ�̬��R�ĵ��ʳ���̬
b.�ȶ���XR>YX4
c.Y��R�γɵĻ�������Y������
��4��д����ҵ��ȡY�ĵ��ʵĻ�ѧ����ʽ___��
��5����Ӧ3X2(g)+P2(g)![]() 2PX3(g)�����е������仯��ͼ��ʾ�ش��������⣺
2PX3(g)�����е������仯��ͼ��ʾ�ش��������⣺
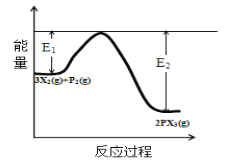
�ٸ÷�Ӧ��___��Ӧ(������������������)��
�ڷ�Ӧ��ϵ�м�������Է�Ӧ���Ƿ���Ӱ��?___��ԭ����___��������˵����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��Ϊ������Ԫ�أ����������ڱ��е�λ����ͼ����֪B��C��Ԫ�������ڱ���������֮����AԪ��������2����B��CԪ�ص�ԭ������֮����AԪ��ԭ��������4������A��B��C���ڵ�һ���ǣ� ��
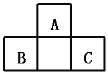
A.Be��Na��AlB.B��Mg��SiC.O��P��ClD.C��Al��P
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʰ�������[(H2NCH2COO)2Fe]��һ�����Ͳ�������ij��ѧѧϰС������ͼ��ʾװ��(�г�����ʡ��)�Ʊ��ʰ���������
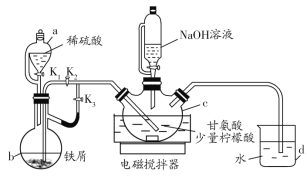
�й������������±���ʾ��
�ʰ���(H2NCH2COOH) | ������ˮ�������Ҵ��������ᣬ�ڱ��������ܽ�ȴ������Ҵ��е��ܽ�ȡ� |
������ | ������ˮ���Ҵ������Խ�ǿ����ǿ��ԭ�ԡ� |
�ʰ������� | ������ˮ���������Ҵ��������ᡣ |
ʵ�鲽�����£�
��.��K1��K3����c��ͨ�����壬��ȷ��c�п������ž���b����Һ���뵽c�С�
��.��50������������ô������������Ͻ��裬Ȼ����c�еμ�NaOH��Һ������ҺpH��5.5���ң�ʹ��Ӧ���ַ�Ӧ��
��.��Ӧ��ɺ���c�з�Ӧ���Һ�м�����ˮ�Ҵ������ɰ�ɫ���������������ˡ�ϴ�ӵôֲ�Ʒ�����ֲ�Ʒ������þ�Ʒ��
�ش��������⣺
��1������b��������__��d��������__��
��2��������н�b����Һ���뵽c�еIJ�����__�����������������ҺpHƫ�ߣ������ôֲ�Ʒ�л��������___(д��ѧʽ)��
��3��c�����ɸʰ��������Ļ�ѧ����ʽ��__��
��4�����й��ڸ�ʵ���˵���������__(��д���)��
a.������п���d�е���ð�����ݵĿ������ж�װ���еĿ����Ƿ��ž�
b.��Ӧ���Һ�м���������������Ƿ�ֹFe2+������
c.������м�����ˮ�Ҵ��������ǽ��ʰ����������ܽ��
d.������г���ϴ��ʱ��������ˮ��ϴ�Ӽ�
��5����ҵ�ϳ��ø������ڷ�ˮ��ϵ�еζ��ʰ���ķ����ⶨ��Ʒ�еĸʰ���ĺ����������ʵ�飬�����ôֲ�Ʒ�еĸʰ���������ֱ�����ڵζ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ģ��ֲ��Ĺ�����ã�������������̫���⡢ˮ��������̼(CO2)�ϳɼ���(CH4)���˹����ϵͳ,�乤��ԭ����ͼ��ʾ������˵����������� ��
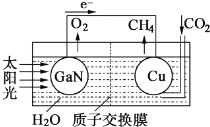
A. GaNΪ����,CuΪ���� B. ��װ����ֻ��������������ת��
C. GaN�缫�ĵ缫��ӦʽΪ2H2O-4e-=4H++O2�� D. ��װ�ù���ʱ,H+��Cu�缫�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɫ�����й�����ζ��Һ�塣ijͬѧ����12.0mL96%�ܶ�Ϊ1.05g/mL�����ᡢ23mL95%�ܶ�Ϊ0.75g/mL���Ҵ���12.0mLŨ���ᡢ����Na2CO3��Һ�Ʊ�������������ʵ��װ����ͼ��ʾ���ձ������ּг�װ�á��¶ȼ�����ȥ����
��֪�����Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 117.9 | 77.2 |

������������ƿB�м����Լ�__��Ȼ��ͨ������A��������__��
�ڼ��ȱ�����ԡ�¶�Ϊ135��145�棬��������Һ��������ֹͣ���ȣ�
��ȡ����֧�ܵ���ƿ����һ�����ı���Na2CO3��Һ��������������εؼ������Һ�У��ٽ�������Һ����ȥˮ�㣬�õ��л��㡣
�Իش��������⣺
��1����������ƿB�����Լ�__��Ȼ��ͨ������A��������__��
��2��д���Ʊ����������Ļ�ѧ����ʽ__��
��3������A��������__��Ũ�����������__������C��������__��
��4����Ӧ�����õ��Ҵ��ǹ����ģ���Ŀ����__��
��5�����м��뱥��̼������Һ������__����������������εؼ��뱥��̼���Ƶ�ԭ����__��
��6���Ӣ��з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ��뱥���Ȼ�����Һ�����__���ټ�����ˮ�����ƣ�Ȼ����������ռ�77.2�����֣��Եõ���������������9.2g�������ʵ�����������������IJ���Ϊ__��д������ı���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2��2H2O��I2===H2SO4��2HI
�� 2HI![]() H2��I2
H2��I2
�� 2H2SO4===2SO2��O2��2H2O
��1������������Ӧ�������ж���ȷ����____________��
a����Ӧ�����ڳ����½��� b����Ӧ����SO2�����Ա�HIǿ
c��ѭ���������貹��H2O d��ѭ�����̲���1 mol O2��ͬʱ����1 mol H2
��2��һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��

0��2 min�ڵ�ƽ����Ӧ����v(HI)��____________�����¶��£�H2(g)��I2(g)![]() 2HI(g)��ƽ�ⳣ��K��____________��
2HI(g)��ƽ�ⳣ��K��____________��
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ��____________�ƶ�(����������ҡ�����)�����������������Լ��е�____________������H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��4����H2Ϊȼ�Ͽ���������ȼ�ϵ�ء�
��֪2H2(g)��O2(g)===2H2O(l) ��H����572 kJ��mol��1
ij����ȼ�ϵ���ͷ�228.8 kJ����ʱ������1 molҺ̬ˮ���õ�ص�����ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�������м��ס����㡢��Լ����ɫ���ŵ㣬���й������������ʵ����(�г�װ��δ����)��˵����ȷ���ǣ���
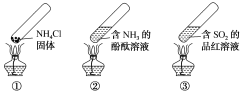
A.����ʱ�������ϲ��㼯��NH4Cl����
B.����ʱ��������Һ��죬��ȴ���ֶ���Ϊ��ɫ
C.����ʱ��������Һ��죬��ȴ���ɫ��ȥ������SO2��������
D.���������ʵ�������������Ļ�ѧ��Ӧ���ǿ��淴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��Radialene����һ����صĻ�״ϩ�����价��ÿһ��̼ԭ�Ӷ�����һ��˫������nԪ������ϩ���Ա�ʾΪ[ n]��ϩ������ͼ�����ּ���ϩ�������й�˵������ȷ����
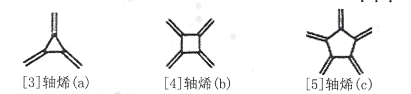
A.a����������ԭ�Ӷ���ͬһ��ƽ����B.b��ʹ����KMnO4��Һ��ɫ
C.c��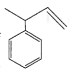 ��Ϊͬ���칹��D.��ϩ��ͨʽ�ɱ�ʾΪC2nH2n��n��3��
��Ϊͬ���칹��D.��ϩ��ͨʽ�ɱ�ʾΪC2nH2n��n��3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com