
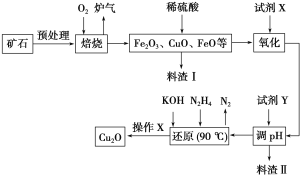
����Ŀ��������ͭ��Cu2O����һ����;�㷺�Ĺ����ϣ�ij��������ͭ��ʯ����CuFeS2��Cu2S�ȣ�Ϊԭ����ȡCu2O�Ĺ����������£�
�����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±���
Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 7.5 | 2.7 | 4.8 |
��ȫ���� | 9.0 | 3.7 | 6.4 |
(1)¯���е��к�����ɷ���__________��Cu2S��O2��Ӧʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(2)���Լ�X��H2O2��Һ��д����Ӧ��Ӧ�����ӷ���ʽ��________�����Լ�X��______ʱ���������ڽ��������ɱ���
(3)�����Լ�Y��pHʱ��pH�ĵ��ط�Χ��___________��
(4)д����N2H4�Ʊ�Cu2O�Ļ�ѧ����ʽ��________������X����_________��ϴ�ӡ���ɣ����к��ʱҪ������������Ŀ����____________��
(5)��ͭ��ʯī���缫�����Ũ��ǿ������Һ���Ƶ�����Cu2O��д������������Cu2O�ĵ缫��Ӧʽ��__________��
���𰸡�SO2 2��1 2Fe2����2H����H2O2=2Fe3����2H2O ���������� 3.7��pH<4.8 4CuSO4��N2H4��8KOH![]() 2Cu2O��N2����4K2SO4��6H2O ���� ��ֹCu2O���������������� 2Cu��2e����2OH��=Cu2O��H2O
2Cu2O��N2����4K2SO4��6H2O ���� ��ֹCu2O���������������� 2Cu��2e����2OH��=Cu2O��H2O
��������
(1)�������ﱺ��ʱת��Ϊ�������������������Cu2S��O2��Ӧʱ�����ݵ�ʧ�����غ㣬�����������뻹ԭ�������ʵ���֮�ȣ�
(2)���������£�H2O2��Fe2������ΪFe3������������ԭΪH2O������������O2Ҳ���Խ�Fe2������ΪFe3����
(3)����pH��Ŀ����ʹ������ȫ��ת��Ϊ��������������ȥ����ͭ���Ӳ����γɳ�����
(4)N2H4��Cu2����ԭΪCu2O������������ΪN2��Cu2O������ˮ�����н�ǿ�Ļ�ԭ�ԣ��ڼ����������ױ�����������
(5)��Cu2O�������������ɵģ�����������ͭ��ͭʧȥ����ת��ΪCu2O���ݴ˽��
(1)�������ﱺ��ʱת��Ϊ�������������������¯���е��к�����ɷ���SO2��Cu2S��O2��Ӧʱ��������ΪO2����ԭ��ΪCu2S��1molO2��4mol���ӣ�Cu�Ļ��ϼ۴�+1������Ϊ+2�ۣ�S�Ļ��ϼ۴�-2������Ϊ+4�ۣ���1molCu2Sʧ8mol���ӣ����ݵ�ʧ�����غ㣬�������뻹ԭ�������ʵ���֮��Ϊ2��1���ʴ�Ϊ��SO2��2��1��
(2)���������£�H2O2��Fe2������ΪFe3������������ԭΪH2O�����ӷ���ʽΪ2Fe2����2H����H2O2=2Fe3����2H2O������������O2Ҳ���Խ�Fe2������ΪFe3����������������۸�Զ����H2O2���������������˫��ˮ��������Ч���������ɱ����ʴ�Ϊ��2Fe2����2H����H2O2=2Fe3����2H2O��������������
(3)����pH��Ŀ����ʹ������ȫ��ת��Ϊ��������������ȥ����ͭ���Ӳ����γɳ�������pH���ط�Χ��3.7��pH<4.8���ʴ�Ϊ��3.7��pH<4.8��
(4)N2H4��Cu2����ԭΪCu2O������������ΪN2����ѧ����ʽΪ4CuSO4��N2H4��8KOH![]() 2Cu2O��N2����4K2SO4��6H2O������Cu2O������ˮ���ʲ���XΪ���ˡ�ϴ�ӡ���ɣ���Cu2O�н�ǿ�Ļ�ԭ�ԣ��ڼ����������ױ������������ʺ�ɹ�����Ҫ�����������ʴ�Ϊ��4CuSO4��N2H4��8KOH
2Cu2O��N2����4K2SO4��6H2O������Cu2O������ˮ���ʲ���XΪ���ˡ�ϴ�ӡ���ɣ���Cu2O�н�ǿ�Ļ�ԭ�ԣ��ڼ����������ױ������������ʺ�ɹ�����Ҫ�����������ʴ�Ϊ��4CuSO4��N2H4��8KOH![]() 2Cu2O��N2����4K2SO4��6H2O�����ˣ���ֹCu2O������������������
2Cu2O��N2����4K2SO4��6H2O�����ˣ���ֹCu2O������������������
(5)��Cu2O�������������ɵģ�����������ͭ��ͭʧȥ����ת��ΪCu2O����Ӧ�ĵ缫��ӦʽΪ2Cu��2e����2OH��===Cu2O��H2O���ʴ�Ϊ��2Cu��2e����2OH��=Cu2O��H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ķ���ϩ�������Ժͻ�ѧ�ȶ����϶��������������ϣ��ų�������֮����������������ɻ���������������У��ܷ����ϣ�����Ѫ�ܣ���ѩ�壬��ճ���ȡ���ϳ�·����ͼ��ʾ��
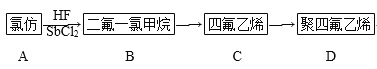
д�����з�Ӧ�Ļ�ѧ����ʽ��A��B��____��B��C��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮFeCl2����ʪ���ױ�����������Ϊ����ѹ���͵ijɷ֡�ijʵ��С��������ˮFeCl3���ȱ�����ɫҺ�壬�е�132.2�棩�Ʊ�������ˮFeCl2�����ⶨ��ˮFeCl2�IJ��ʡ�
ʵ��ԭ����2FeCl3��C6H5Cl![]() 2FeCl2��C6H4Cl2��HCl��
2FeCl2��C6H4Cl2��HCl��
ʵ��װ�ã�����ͼ��ʾ��װ�õ�װ�ã���������Ժ���������ƿA�м���16.76g��ˮFeCl3��22.5g�ȱ���
�ش��������⣺

��1�����ù�ҵ����������H2O��O2��CO2����ȡ��������ĵ�����
���������װ����ѡ���Ҫ��װ�ã�ȷ�������������˳��a��________����ͼ�е�j�ڣ�������������Сд��ĸ��ʾ����

��ʵ����ɺ�ͨ�뵪������ҪĿ����________��
��2��װ��C�е��Լ���________�����Լ����ƣ�����������________��
��3����������������Լ126�������¾��ҽ���30min�����ϱ�ɺ�ɫ��״������װ��A���ѡ��__������ĸ����
a���ƾ��� b��ˮԡ�� c�����¯ d����ԡ��
��4���������£���128��139�������¼���2h���������ɫ��dz���Ƚ��͡��ò����м����¶��Ѿ��ӽ����ȱ��е㣬���ȱ�ʵ����ʧ��ȴ�dz�С����ԭ����________��
��5����������1h�������ȴ���ڸ������������¹��˳����壬��ϴ�Ӽ����ϴ�����ù��壬��������и���õ���Ʒ����D��������Һǡ����25mL2.0mol��L��1NaOH��Һ��ȫ��Ӧ�����ʵ����FeCl2�IJ���ԼΪ________������3λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ���������ֵ�������й�˵����ȷ����
A.60�˵�����������ǻ������ȼ������O2������Ϊ2NA
B.5.8g��ʯ�ࣨ2CaSO4��H2O�����еĽᾧˮ������Ϊ0.04NA
C.��4.6g�Ҵ���ȫ���������ȩ��ת�Ƶ�����Ϊ0.1NA
D.ʵ������ȡ���������ж��֣���ȡ1molO2ת�Ƶ���������4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ȫ��������������������ͭ������Ǧ��п,����ɫ��������λ������ҵ��չ�̲��ž�DZ����
��.(1)���������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��
�ٻ�̬Ni2+�ĺ�������Ų�ʽΪ_________________��
����[Ni(NH3)6]2���д��ڵĻ�ѧ������_____________��
A�����Ӽ� B.���ۼ� C.��λ�� D. ��� E.������ F������
��.����ͪ��Ǽ���Ni2+�������Լ���
(2)����ͪ뿷���![]() ��Cԭ�ӹ��������Ϊ________________��1mol����ͪ뿷���������������ĿΪ_____________��
��Cԭ�ӹ��������Ϊ________________��1mol����ͪ뿷���������������ĿΪ_____________��
(3)�����[Ni(CO)4]������ΪҺ̬��������CCl4�������л��ܼ���
�� [Ni(CO)4]��̬ʱ����________����(�������)��
��[Ni(CO)4]��Ni��CO��Cԭ���γ���λ���������ǿռ乹�ͣ�[Ni(CO)4]�Ľṹ����ʾ��ͼ��ʾΪ_____________ (����������ʾ����λ��) ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ�ã���ش�
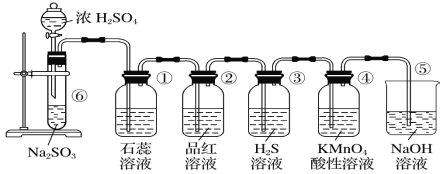
��1���ڢ��з�����Ӧ�Ļ�ѧ����ʽΪ________��
��2�����е�ʵ������Ϊʯ����Һ__________��֤��SO2��ˮ��Һ��_______�ԡ�
��3�����е�Ʒ����Һ________��֤��SO2��________�ԡ�
��4�����е�ʵ��������________________________��֤��SO2��____________�ԡ�
��5�����е�ʵ��������______��֤��SO2��______�ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ��������������Wԭ�ӵ�������������X��Zԭ������������֮�ͣ�W���⻯��r����ˮ��ȫ���롣m��p������ЩԪ����ɵĶ�Ԫ�����m�������������ɫ����p��������Ϊ����ɫ������˵����ȷ���ǣ� ��
A.�����Ӱ뾶��W>Z>Y>X
B.Yԭ�ӵļ۵��ӹ����ʾʽΪ![]()
C.r��m���γ����ӻ�����������ӵ���ʽΪ![]()
D.һ�������£�m����Z�ĵ��ʷ�Ӧ����p
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����������Ƽ�ȩ(NaHSO2��HCHO��2H2O)�IJ������£�����ƿ�е�����������Һͨ��SO2�Ƶ�NaHSO3����װ��A�е����ܻ�����Ƥ�����ټ���п�ۺͼ�ȩ��Һ����80��90���£���ӦԼ3h����ȴ�����£����ˣ�����Һ�����������������Ũ������ȴ�ᾧ������˵��������ǣ� ��
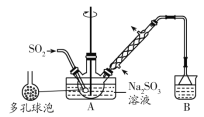
A.�����������ƹ����70%��������ȡ������������
B.������ݵ�������������������Һ�ĽӴ������ʹ��Ӧ��ֽ���
C.װ��B���Լ�������NaOH��Na2CO3��Һ
D.װ��A�пɲ�����ԡ��ɳԡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ�ɫ���壬������������Ӱ�������͵�ز��ϵȡ�
ʵ�����Ʊ������������ⶨ����Fe2+��C2O42�����ʵ���֮��ȷ���䴿�ȣ��������£�
������ȡһ�����������������[(NH4)2Fe(SO4)2]���ձ��У�������ˮ��ϡ���ᣬ�����ܽ⣬�ټӱ���H2C2O4��Һ�����ȷ��������ӣ���ȴ�����ˡ�ϴ�ӡ����ɣ��û�ɫ���塣
������ȡm g�����Ƶõľ�������ƿ�У��������ϡ����ʹ���ܽ⣬70��ˮԡ���ȣ���c mol��L1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һv1 mL����������������KMnO4����Ӧ����
���������ζ������Һ�м������п�ۺ�ϡ���ᣬ��У�����Ӧ��ȫ�����ˣ���c mol��L1 KMnO4��Һ�ζ���Һ���յ㣬����KMnO4��Һv2 mL��
�����ظ�����ʵ��3�Σ����㡣
��֪���������������ᡣ
����pH>4ʱ��Fe2+�ױ�O2������
�������������£�KMnO4��Һ�Ļ�ԭ����Ϊ������ɫ��Mn2+��
�ش��������⣺
��1�����м���ϡ�����Ŀ����__________________________��_______________________��
��2��������KMnO4��Һ��Ӧ������_____________��____________��
��3�����м������п�۽���Fe3+��ȫ��ԭΪFe2+����δ��������п�ۣ�������KMnO4��Һ�����V ______v2 mL������������������������������
��4�����У��ζ�ʱ��Ӧ�����ӷ���ʽ��__________________________,�ζ�ʱKMnO4��Һװ��__________________��������������,�ζ��յ������_________________________________________��
��5��m g�����Ƶõľ����У�Fe2+��C2O42�����ʵ���֮����____________________���ú�v1�� v2�ļ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com