
【题目】短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为![]()
C.r与m可形成离子化合物,其阳离子电子式为![]()
D.一定条件下,m能与Z的单质反应生成p
【答案】D
【解析】
短周期元素X、Y、Z、W的原子序数依次增大。m可做制冷剂,则m为NH3,则X为H;无色气体p遇空气变为红棕色,则p为NO;N元素的简单氢化物是非电解质,所W不是O、N,则Y为N,Z为O,W原子的最外层电子数是X与Z原子最外层电子数之和,且其简单氢化物r溶于水完全电离,则W为Cl。
A.电子层数越多离子半径越大,电子层数相同,原子序数越小半径越大,所以简单离子半径:Cl->N3->O2->H+,故A错误;
B.Y为N,其价层电子为2s22p3,价电子轨道表示式为:![]() ,故B错误;
,故B错误;
C.r与m可形成离子化合物氯化铵,铵根的正确电子式为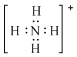 ,故C错误;
,故C错误;
D.氨气与氧气在催化剂加热的条件下可以生成NO,故D正确;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
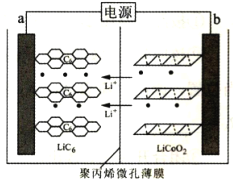
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2![]() C6+LiCoO2
C6+LiCoO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
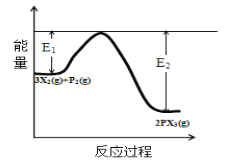
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
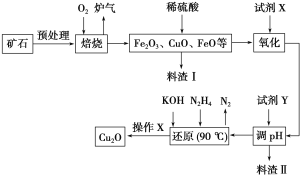
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成了一种能自动愈合自身内部细微裂纹的神奇塑料,合成路线如图所示:
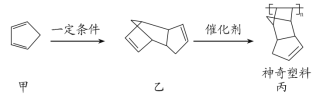
下列说法正确的是( )
A.甲的化学名称为2,4-环戊二烯
B.一定条件下,1mol乙与1molH2加成的产物可能为![]()
C.若神奇塑料的平均相对分子质量为10000,则其平均聚合度约为90
D.甲的所有链状不饱和烃稳定结构的同分异构体有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅酸盐材料的说法正确的是![]()
A.SiO2既可以与NaOH溶液反应,也可以与氢氟酸反应,因此SiO2属于两性氧化物
B.高纯度的硅单质广泛用于制作光导纤维
C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D.长石的主要成分为KAlSi3O8,用氧化物形式表示为K2OAl2O36SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )
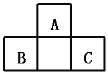
A.Be、Na、AlB.B、Mg、SiC.O、P、ClD.C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(H2NCH2COO)2Fe]是一种新型补铁剂。某化学学习小组用如图所示装置(夹持仪器省略)制备甘氨酸亚铁。
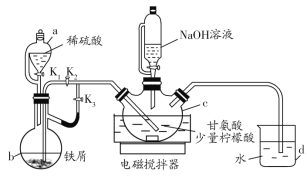
有关物质性质如下表所示:
甘氨酸(H2NCH2COOH) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸仲溶解度大于在乙醇中的溶解度。 |
柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸。 |
实验步骤如下:
Ⅰ.打开K1、K3,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入到c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器b的名称是__,d的作用是__。
(2)步骤Ⅰ中将b中溶液加入到c中的操作是__;步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有杂质___(写化学式)。
(3)c中生成甘氨酸亚铁的化学方程式是__。
(4)下列关于该实验的说法错误的是__(填写序号)。
a.步骤Ⅰ中可由d中导管冒出气泡的快慢来判断装置中的空气是否排尽
b.反应混合液中加入柠檬酸的作用是防止Fe2+被氧化
c.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
d.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)工业上常用高氯酸在非水体系中滴定甘氨酸的方法测定产品中的甘氨酸的含量。请设计实验,将所得粗产品中的甘氨酸分离出来直接用于滴定:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是()
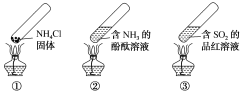
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com