
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
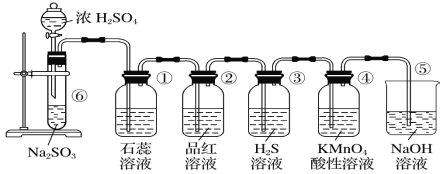
(1)在⑥中发生反应的化学方程式为________。
(2)①中的实验现象为石蕊溶液__________,证明SO2的水溶液显_______性。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
【答案】Na2SO3 + H2SO4(浓)= Na2SO4 + SO2↑ + H2O 变红, 酸 褪色 漂白 有黄色沉淀生成 氧化性 酸性高锰酸钾褪色 还原性
【解析】
(1)亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠和水;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色;
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫;
(5)二氧化硫具有还原性,能够被酸性高锰酸钾溶液氧化。
(1)①中为亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑。
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:变红;酸性。
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,故答案为:褪色;漂白。
(4)SO2中+4价S具有氧化性,硫化氢中-2价S具有还原性,二氧化硫能把硫化氢氧化成单质硫,本身被还原成单质硫,反应方程式为SO2+2H2S=3S↓+2H2O,故答案为:有黄色沉淀生成;氧化。
(5)二氧化硫具有还原性,能够被酸性高锰酸钾容易氧化,使酸性高锰酸钾溶液褪色,故答案为:酸性高锰酸钾褪色;还原性。


科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,Y与W同族,W的核电荷数是Y的两倍,四种元素组成的一种化合物如图所示。下列说法一定正确的是( )
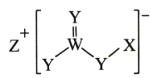
A.简单离子半径:Z>W>Y>X
B.最简单氢化物的稳定性:W>Y
C.X与Z可形成离子化合物ZX
D.W的氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为:S+2KNO3+3C===K2S+N2↑+3CO2↑。
(1)氮原子的价层电子排布图为___________,烟花燃放过程中,钾元素中的电子跃迁的方式是___________,K、S、N、O四种元素第一电离能由大到小的顺序为___________。上述反应涉及的元素中电负性最大的是___________(填元素符号)。
(2)碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(结构式为![]() )。C2O3与水反应可生成草酸(HOOC—COOH)。
)。C2O3与水反应可生成草酸(HOOC—COOH)。
①C2O3中碳原子的杂化轨道类型为___________,CO2分子的立体构型为___________。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是______________________。
③CO分子中π键与σ键个数比为___________。
(3)超氧化钾的晶胞结构图如下:

则与K+等距离且最近的K+个数为___________,若晶胞参数为dpm,则该超氧化物的密度为___________g·cm-3(用含d、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
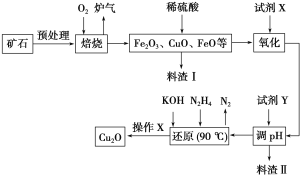
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是( )
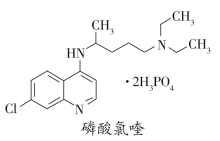
A.分子式是C18H32ClN3O8P2
B.能发生取代、加成和消去反应
C.1mol磷酸氯喹最多能与5molH2发生加成反应
D.分子中的—C1被—OH取代后的产物能与溴水作用生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅酸盐材料的说法正确的是![]()
A.SiO2既可以与NaOH溶液反应,也可以与氢氟酸反应,因此SiO2属于两性氧化物
B.高纯度的硅单质广泛用于制作光导纤维
C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D.长石的主要成分为KAlSi3O8,用氧化物形式表示为K2OAl2O36SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,控制条件改变0.1mol·L-1二元弱酸H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4-、C2O42-的物质的量分数δ(X)随pOH的变化如图所示。已知pOH=-lgc(OH-),![]() 。下列叙述错误的是( )
。下列叙述错误的是( )
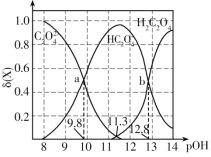
A.反应H2C2O4+C2O42-![]() 2HC2O4-的平衡常数的值为103
2HC2O4-的平衡常数的值为103
B.若升高温度,a点移动趋势向右
C.pH=3时,![]() =100.6:1
=100.6:1
D.物质的量浓度均为0.1mol·L-1的Na2C2O4、NaHC2O4混合溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
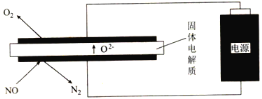
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com