
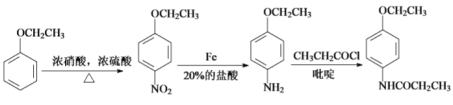
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
【答案】甲苯 氟原子 浓硫酸和浓硝酸、加热 取代反应(或硝化反应) 吸收反应产生的氯化氢,提高反应物转化率 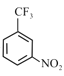 +2Fe+4HCl
+2Fe+4HCl![]()
 +2FeCl2+2H2O 276 13
+2FeCl2+2H2O 276 13 ![]()
【解析】
A中含有1个苯环,由B的分子式可知A为![]() ,则B为
,则B为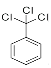 ,B中的氯原子被氟原子取代生成了C,C的结构简式为
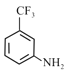
,B中的氯原子被氟原子取代生成了C,C的结构简式为![]() ,C发生硝化反应生成D,D中硝基被还原成氨基生成E,E与酰氯发生取代反应生成F,F的结构简式为
,C发生硝化反应生成D,D中硝基被还原成氨基生成E,E与酰氯发生取代反应生成F,F的结构简式为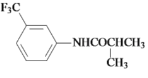 ,然后发生硝化反应生成G,结合对应的有机物的结构和性质解答。
,然后发生硝化反应生成G,结合对应的有机物的结构和性质解答。
(1)由以上分析可知A为甲苯,结构简式为![]() ,C中官能团的名称为氟原子,故答案为:甲苯;氟原子。
,C中官能团的名称为氟原子,故答案为:甲苯;氟原子。
(2)③为三氟甲苯的硝化反应,反应条件是在浓硫酸作用下,水浴加热,与浓硝酸发生取代反应,故答案为:浓硫酸和浓硝酸、水浴加热;取代反应(或硝化反应)。
(3)反应⑤的方程式为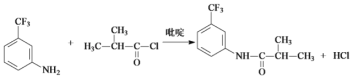 ,反应中生成了HCl,加入吡啶这样的有机碱,可以消耗产生的氯化氢,促进平衡右移,提高反应转化率,故答案为:消耗反应中生成的氯化氢,促进平衡右移,提高产率。
,反应中生成了HCl,加入吡啶这样的有机碱,可以消耗产生的氯化氢,促进平衡右移,提高反应转化率,故答案为:消耗反应中生成的氯化氢,促进平衡右移,提高产率。
(4)由题中转化关系可知反应④的化学方程式为: +2Fe+4HCl
+2Fe+4HCl![]()
 +2FeCl2+2H2O,故答案为:
+2FeCl2+2H2O,故答案为: +2Fe+4HCl
+2Fe+4HCl![]()
 +2FeCl2+2H2O。
+2FeCl2+2H2O。
(5)由结构简式可知G的分子式为C11H11O3N2F3,则相对分子质量为276,故答案为:276。
(6)T(C7H7NO2)是E在碱性条件下的水解产物,显然有1个羧基,它的同分异构体,要求:①—NH2直接连在苯环上②能与新制氢氧化铜悬浊液共热产生红色固体,说明结构中含有醛基。分析可知,T符合条件的同分异构体分两大类:一类是苯环上有2个取代基:—NH2和HCOO—,在苯环上按邻、间、对排列方式共有3种,另一类是苯环上有3个取代基:—OH、—CHO、—NH2,3个不同的取代基在苯环上的排列方式共有10种结构,所以一共有13种符合条件的同分异构体。其中核磁共振氢谱上有4组峰,且峰面积比为1:2:2:2的物质的结构简式为:![]() ,故答案为:13;
,故答案为:13;![]() 。
。
(6)由目标产物逆推,需要合成氨基,推知原料要先发生硝化,引入硝基,再还原得到氨基,氨基与酰氯发生取代反应生成目标产物,合成路线为: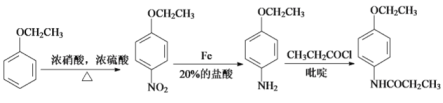 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
(1)写出B的结构简式_______
(2)反应②和④的反应类型分别是_______、_______。
(3)实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程式为_______。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,回答问题:
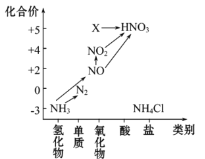
(1)上图中 X 的化学式为______,从化合价上看,X 具有_______性(填“氧化”或“还原”);
(2)写出 NO2 与水反应的化学方程式____________;
(3)写出稀硝酸与铜反应的离子方程式____________;
(4)实验室常用 NH4Cl与 Ca(OH)2 制取氨气,写出反应的化学方程式_________;
(5)下列试剂不能用于干燥 NH3 的是________ (填字母);
A.浓硫酸 B.碱石灰 C.NaOH 固体
(6)氨气是重要的化工原料,写出其催化氧化的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老鼠能在多氟碳化物溶液内部潜水游动,科学家预测多氟碳化物可能成为血液替代品。全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中不正确的是( )
A. 原子半径C比F的大
B. 全氟丙烷的电子式为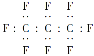
C. 全氟丙烷分子中只含σ键
D. 全氟丙烷分子中既含极性键又含非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:

(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。

②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如右图:
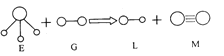
下列判断错误的是
A.G是最活泼的非金属单质B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色D.M是化学性质很活泼的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列有关说法正确的是
A.60克的乙酸和葡萄糖混合物充分燃烧消耗O2分子数为2NA
B.5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.04NA
C.把4.6g乙醇完全氧化变成乙醛,转移电子数为0.1NA
D.实验室制取氧气方法有多种,制取1molO2转移电子数均是4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
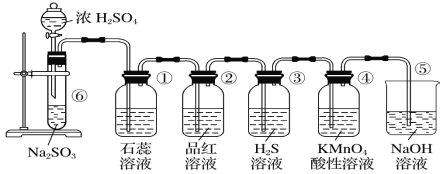
(1)在⑥中发生反应的化学方程式为________。
(2)①中的实验现象为石蕊溶液__________,证明SO2的水溶液显_______性。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为纳米二氧化锰燃料电池,其电解质溶液呈酸性,已知(CH2O)n中碳的化合价为0价,有关该电池的说法正确的是

A. 放电过程中左侧溶液的pH降低
B. 当产生22gCO2时,理论上迁移质子的物质的量为4mol
C. 产生22gCO2时,膜左侧溶液的质量变化为:89g
D. 电子在外电路中流动方向为从a到b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com