
【题目】原电池是( )装置
A. 化学能转化为电能 B. 电能转化为化学能
C. 热能转化为化学能 D. 化学能转化为热能
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.葡萄糖、果糖和蔗糖都能发生水解反应
B.糖类、油脂、蛋白质都是由C、H、O三种元素组成的
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
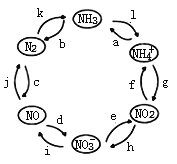
(1)氮分子的电子式为______________________。
(2)图中属于“氮的固定”的是___________(填字母)。
(3)已知NH4Cl溶液呈酸性,用离子方程式解释原因___________________________________________ 。
(4)用离子方程式举一例表示循环中发生非氧化还原反应的过程__________________。
(5)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为____________。
(6)若反应i是在酸性条件下由NO3—与Fe2+的作用实现,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]、硫氰[(SCN)2]等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2=2Fe(SCN)3、Ag++CN-= AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2=2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (OCN)2+H2O=2H++OCN-+OCNO-
D. MnO2+4HSCN![]() Mn(SCN)2+ (SCN)2↑+2H2O
Mn(SCN)2+ (SCN)2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是( )
A. Si、P、S的第一电离能随原子序数的增大而增大
B. 价电子排布为3d64s2的元素位于第四周期第ⅧB族,是d区元素
C. 2p和3p轨道形状均为哑铃形,能量不相等
D. 氮原子的最外层电子排布图:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。
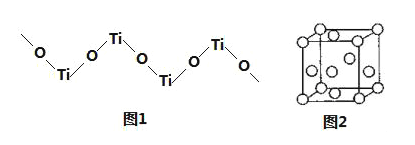
(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
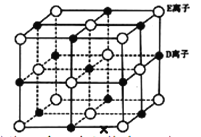
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com