
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
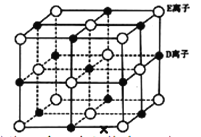
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
【答案】C O N sp3 哑铃型 3d104s1 3:4 Na、Cs处于同一主族,并都是金属晶体,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低 8 ![]()
【解析】
A、B、C、D、E、F为前四周期元素且原子序数依次增大,基态A原子的电子分布在3个能级,且每个能级所含的电子数相同,A原子核外有6个电子,A是C元素;D是短周期元素中电负性最小的元素,D是Na元素;C的原子核外最外层有 6 个运动状态不同的电子,则C最外层电子数为6,C是O元素、B是N元素;E的最高价氧化物的水化物酸性最强,E是Cl元素;基态F原子核外最外层只有一个电子,其余能层均充满电子,F是Cu元素。G元素与D元素同主族,且相差3个周期,G是Cs元素。
根据以上分析,(1)元素 A、 B、 C 分别是C、N、O,同周期元素从左到右第一电离能逐渐增大,N原子2p轨道处于半充满状态,N的第一电离能大于O,所以第一电离能由小到大的是C<O<N。(2)E是Cl元素,最高价含氧酸是HClO4, Cl价电子对数是![]() ,Cl的杂化方式为sp3。 基态 Cl原子中,最高能级是3p,电子云轮廓形状为哑铃型。(3)Cu原子核外有29个电子,3d能级处于全满或半满时为稳定结构,所以Cu外围电子排布式为3d104s1;(4)已知元素 C、N形成的(CN)2分子中所有原子都满足 8电子稳定结构,则(CN)2的结构式是N
,Cl的杂化方式为sp3。 基态 Cl原子中,最高能级是3p,电子云轮廓形状为哑铃型。(3)Cu原子核外有29个电子,3d能级处于全满或半满时为稳定结构,所以Cu外围电子排布式为3d104s1;(4)已知元素 C、N形成的(CN)2分子中所有原子都满足 8电子稳定结构,则(CN)2的结构式是N![]() C-C
C-C![]() N,则其分子中有3个σ键和4个π键,数目之比为3:4。(5)通常情况下,D单质是金属钠,G的单质是金属铯,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低,所以钠的熔沸点比铯高。(6)该晶胞棱上有12个碳原子,晶胞中心1个碳原子,“小立方体”中心各放置一个碳原子,所以晶胞中碳原子数是
N,则其分子中有3个σ键和4个π键,数目之比为3:4。(5)通常情况下,D单质是金属钠,G的单质是金属铯,同主族元素价电子数相同,从上到下,原子半径依次增大,金属键依次减弱,熔沸点降低,所以钠的熔沸点比铯高。(6)该晶胞棱上有12个碳原子,晶胞中心1个碳原子,“小立方体”中心各放置一个碳原子,所以晶胞中碳原子数是![]() ;晶胞的摩尔质量是8
;晶胞的摩尔质量是8![]() 12g/mol=96g/mol,把晶胞分成4个小立方体,每个立方体的对角线是键长的2倍,可推出整个晶胞的边长是
12g/mol=96g/mol,把晶胞分成4个小立方体,每个立方体的对角线是键长的2倍,可推出整个晶胞的边长是![]() ,晶胞的体积是
,晶胞的体积是![]() ,该晶体的密度是
,该晶体的密度是![]() g·cm-3。
g·cm-3。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】下列有关烷烃的叙述中,不正确的是
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与Cl2发生取代反应
C. 如图所示,将1体积甲烷和4体积Cl2充入试管中,一段时间后,将看到水槽底部有油状液滴生成,试管内充满水
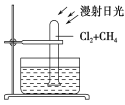
D. 甲烷与Cl2在光照条件下发生反应的产物中,HCl的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:烃的衍生物A的摩尔质量为32 g·molˉ1,且能与金属钠反应。E的分子式为C3H6O2。有关物质的转化关系如下:
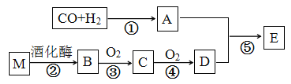
请回答:
(1)D中含有的官能团名称是____________,反应⑤的反应类型为_________。
(2)写出烃的衍生物A与金属钠反应的化学方程式__________________________。
(3)写出反应②的化学方程式____________。写出反应③的化学方程式______________。
(4)写出有机物E与NaOH溶液反应的化学方程式_______________________。
(5)下列说法正确的是________。
A.有机物C的水溶液常用于标本的防腐
B.有机物B、D都能与金属钠发生反应
C.有机物E中混有D,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A. Zn与稀硫酸反应放出氢气 B. 酸碱中和反应
C. 硫在空气或氧气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
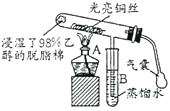
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
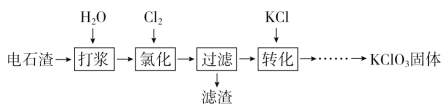
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。
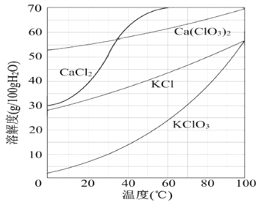
若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com