
【题目】以下烃中,一氯代物只有一种的是( )
A. CH(CH3)3 B. CH3CH2CH3 C. CH3CH2CH2CH3 D. C(CH3)4
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
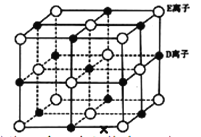
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期第ⅡA、ⅢA族金属元素的原子失去电子后,生成的阳离子的电子层结构( )。
A.与它同周期稀有气体元素原子的电子层结构相同
B.与它上一周期稀有气体元素原子的电子层结构相同
C.与它下一周期稀有气体元素原子的电子层结构相同
D.以上说法都不全面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
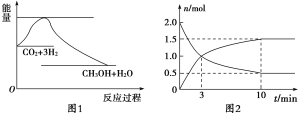
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
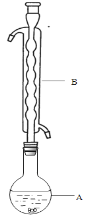
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com