
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
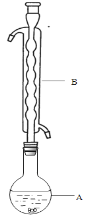
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。
【答案】蒸发浓缩 冷却结晶 球形冷凝管 冷凝回流 增加反应物接触面积,提高反应速率 蒸发浓缩 冷却结晶 Na2SO4 取少量滤液于试管中,加稀盐酸至溶液呈酸性,静置,取上层清液(或过滤除去S后的滤液)于另一支试管中,向该试管中滴加BaCl2溶液,若出现浑浊,证明原滤液中含Na2SO4 酸式 101.2% 含有的Na2SO3也会和I2发生反应,从而影响纯度
【解析】
本题以Na2S2O3·5H2O晶体的制备及其样品纯度的测定为背景,考查考生对化学实验仪器的认识和解决实际问题的能力。硫粉不溶于水,制备过程硫粉与水溶液中的Na2SO3不能充分的接触,影响反应速率,用乙醇湿润硫粉的目的就要从这些方面分析。温度越高Na2S2O3溶解度越大,所以冷却其较高温度下的饱和溶液,可得到Na2S2O3·5H2O晶体。SO32-有较强的还原性,加热条件下更易被溶解在溶液中的O2氧化,分析滤液中的杂质要考虑这一点。用已知浓度的碘水滴定Na2S2O3溶液来测定样品纯度,而I2也能够氧化SO32-,这是实验原理不完善带来的系统误差。由此分析。
(1)根据装置图可知,仪器B为球形冷凝管,使水蒸气冷凝回流,防止反应液中水分大量流失而析出晶体。硫粉难溶于水而微溶于乙醇,用乙醇湿润可使硫粉易于分散到溶液中,增大硫与Na2SO3的接解面积,加快反应速率。
(2)由100C和700C下的Na2S2O3的溶解度数据可知,温度越高Na2S2O3溶解度越大,可以先蒸发浓缩得到较高温度下的Na2S2O3的饱和溶液,然后冷却结晶,即可制备Na2S2O3·5H2O晶体。所以步骤④应采取的操作是蒸发浓缩、冷却结晶。
(3)SO32-具有较强的还原性,加热过程中溶解在溶液中的O2氧化了部分SO32-生成SO42-,所以滤液中很可能存在Na2SO4。检验Na2SO4的存在,只需检验SO42-离子,但要排除SO32-和S2O32-的干扰,先用盐酸酸化:Na2SO3+2HCl=SO2↑+H2O+2NaCl,Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl,再加入BaCl2溶液:Ba2++SO42-=BaSO4↓,产生不溶于盐酸的白色沉淀即证明滤液中含Na2SO4杂质。所以检验方法是:取少许滤液于试管中,加稀盐酸至溶液呈酸性,静置,取上层清液(或过滤除去S后的滤液)于另一支试管中,向该试管中加入BaCl2溶液,若出现浑浊则证明原滤液中含Na2SO4。
(4) I2能与橡胶发生加成反应而腐蚀橡胶,不能用碱式滴定管,只能用酸式滴定管盛装碘水进行滴定。由表中数据可知三次实验消耗碘水体积分别为30.22mL、30.70mL、30.18mL,显然第二次实验误差太大舍去,平均消耗碘水体积为![]() =30.20mL。设所配样品溶液的浓度为c(Na2S2O3),
=30.20mL。设所配样品溶液的浓度为c(Na2S2O3),
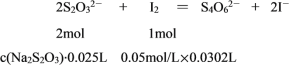
列比例式:![]() ,解得c(Na2S2O3)=0.1208mol/L
,解得c(Na2S2O3)=0.1208mol/L
7.40g样品中Na2S2O3·5H2O的物质的量=n(Na2S2O3)=0.25L×0.1208mol/L=0.0302mol,样品的纯度=![]() ×100%=101.2%。因为SO32-有较强的还原性,也能被I2氧化,所以滴定中消耗的碘水体积偏大,使计算得到的纯度值偏大。
×100%=101.2%。因为SO32-有较强的还原性,也能被I2氧化,所以滴定中消耗的碘水体积偏大,使计算得到的纯度值偏大。


科目:高中化学 来源: 题型:
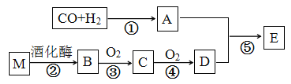
【题目】已知:烃的衍生物A的摩尔质量为32 g·molˉ1,且能与金属钠反应。E的分子式为C3H6O2。有关物质的转化关系如下:
请回答:
(1)D中含有的官能团名称是____________,反应⑤的反应类型为_________。
(2)写出烃的衍生物A与金属钠反应的化学方程式__________________________。
(3)写出反应②的化学方程式____________。写出反应③的化学方程式______________。
(4)写出有机物E与NaOH溶液反应的化学方程式_______________________。
(5)下列说法正确的是________。
A.有机物C的水溶液常用于标本的防腐
B.有机物B、D都能与金属钠发生反应
C.有机物E中混有D,可用饱和碳酸钠溶液进行分离
D.有机物M为高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
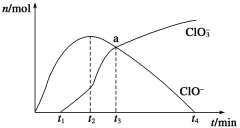
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA溶液和KOH溶液等体积混合,实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 实验①反应后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 实验②反应后的溶液中:[K+]=[A-]>[OH-]=[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
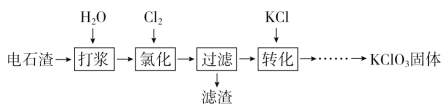
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。
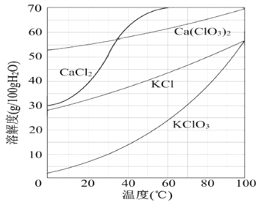
若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是________ →________ →________ →D→________(均用字母填写)。
(2)滴定管的读数应注意_________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤中液面应调节到____________________,尖嘴部分应__________________。
(5)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是_____________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com