
【题目】室温下,将一元酸HA溶液和KOH溶液等体积混合,实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 实验①反应后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 实验②反应后的溶液中:[K+]=[A-]>[OH-]=[H+]
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物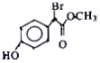 是一种扁桃酸衍生物,下列关于该有机物的说法正确的是
是一种扁桃酸衍生物,下列关于该有机物的说法正确的是
A. 该有机物的分子式为C9H8O3Br
B. 分子中所有的碳原子一定在同一平面内
C. 1mol该有机物最多与2mol NaOH反应
D. 该有机物的同分异构体中,属于一元羧酸和酚类化合物且苯环上只有2个取代基的有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
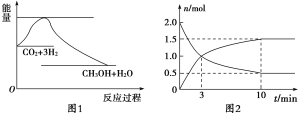
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
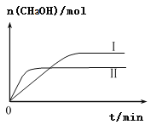
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
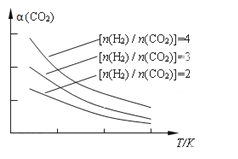
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
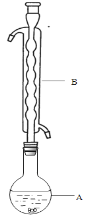
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为______________________________________。
(2)B为0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因___________________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与生产、生活和科技密切相关。回答下列问题:
(1)下列物质中属于复合材料的是___________(填标号)。
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.水泥
(2)钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,请以氧化物组成的形式表示钾长石的化学式____________。
(3)新型无机非金属材料碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C![]() SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________。
(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________________。
②铝热反应可用于冶炼难熔的金属,请写出Al与Cr2O3反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A不能使酸性KMnO4溶液褪色,含碳量为92.3%,0.1mol A完全燃烧时生成13.44L二氧化碳(标准状况)。
(1)A的结构简式为_________。
(2)根据下列条件写出有关反应的化学方程式并指明反应类型:
①A与浓硫酸和浓硝酸的混合液反应生成B:__________,___________反应。
②在催化剂作用下A与H2反应生成C:_______________,__________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com