
【题目】下列物质间的转化不能一步实现的是( )
A. N2→NO2 B. HNO3→O2 C. SO2→H2SO4 D. H2SO4→SO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A. Zn与稀硫酸反应放出氢气 B. 酸碱中和反应
C. 硫在空气或氧气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
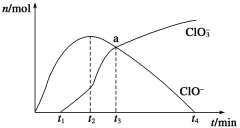
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA溶液和KOH溶液等体积混合,实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 实验①反应后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 实验②反应后的溶液中:[K+]=[A-]>[OH-]=[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
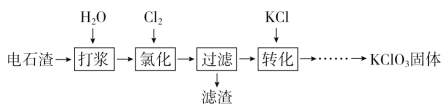
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。
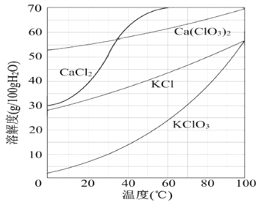
若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯、乙酸、乙醇说法正确的是
A. 都不易溶于水
B. 除乙酸外,其余都不能与金属钠反应
C. 苯能与溴水在铁作催化剂下发生取代反应
D. 乙醇与乙酸都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是________ →________ →________ →D→________(均用字母填写)。
(2)滴定管的读数应注意_________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤中液面应调节到____________________,尖嘴部分应__________________。
(5)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是_____________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油(C3H8O3)转化为高附值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:

(1)下列说法正确的是______(填字母序号)。
a.消耗等量的甘油,反应I的产氢率最高
b.消耗等量的甘油,反应II的放热最显著
c.经过计算得到反应III的H3=-237.5 kJ/mol,
d.理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应III设定在较高温度(600~700°C)进行,选择该温度范围的原因有:催化剂活性和选择性高、____________。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:__________________。
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:____________________。
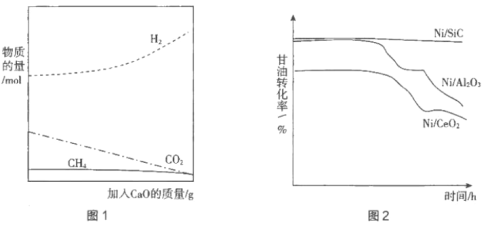
(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是____________________。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2 ![]() La2O2CO3
La2O2CO3
第二步为:______________________________(写出化学反应方程式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com