
【题目】下列化合物的化学键中,只有离子键的是( )
A.NH4ClB.MgCl2C.Na2CO3D.K2SO4
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列图示的实验设计能实现相应实验目的的是
A. 
验证FeCl3溶液中是否含有Fe2+
B. 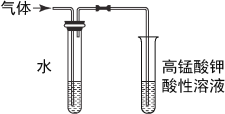
检验溴乙烷消去的产物
C. 
检验氯气与亚硫酸钠是否发生反应
D. 
对比Fe3+和Cu2+对H2O2分解的催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期第ⅡA、ⅢA族金属元素的原子失去电子后,生成的阳离子的电子层结构( )。
A.与它同周期稀有气体元素原子的电子层结构相同
B.与它上一周期稀有气体元素原子的电子层结构相同
C.与它下一周期稀有气体元素原子的电子层结构相同
D.以上说法都不全面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述错误的是
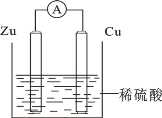
A. 锌是负极,其质量逐渐减小
B. 氢离子在铜表面得e-
C. 电子从锌片经导线流向铜片
D. 电流从锌片经导线流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的相对分子质量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
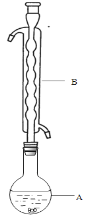
④滤液在经过______________、_____________后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________,其作用是____________________,加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④应采取的操作是_________________、________________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是___________。如果滤液中该杂质的含量不很低,其检测的方法是:______________________________。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用__________(填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 30.52 |
第二次 | 0.36 | 31.06 |
第三次 | 1.10 | 31.28 |
则所得产品的纯度为______________________________,你认为影响纯度的主要原因是(不考虑操作引起误差)_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
B. 向氨水中加入少量H2C2O4溶液:H2C2O4 +2NH3·H2O ![]() C2O4 2—+2NH
C2O4 2—+2NH![]() +2H2O
+2H2O
C. 氢氧化钠溶液中加入铝粉:2Al+2OH- +6H2O === 2Al(OH)4-+3H2↑
D. 向CuSO4溶液中加入Na2O2:2Na2O2+2H2O===4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是一些晶体的结构示意图。
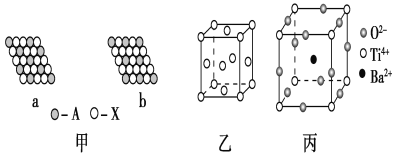
(1)下列关于晶体的说法正确的是________(填字母)。
A.晶体的形成与晶体的自范性有关
B.可以用X射线衍射仪区分晶体和非晶体
C.石蜡是非晶体,但有固定的熔点
D.晶胞就是晶体
(2)图甲表示的是晶体的二维平面示意图,a、b中可表示化学式为AX3的化合物的是________。(填“a”或“b”)
(3)图乙表示的是金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________,铜原子的配位数为________。
②该晶胞称为________(填字母)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
(4)图丙为钛酸钡晶体的晶胞结构,该晶体经X射线分析得出,重复单位为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
①写出该晶体的化学式:_____________________________。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的________位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com